Todos en algún momento nos hemos topado con una transformación física de una sustancia química y tal vez no te hayas dado cuenta de esto. Porque en muchos casos son procesos cotidianos que para ti no tienen mucha relevancia pero que ciertamente para el universo significa algún cambio en los equilibrios. Para orientarlos en el tema solo piensen que cuando un cubo de hielo se derrite, aunque la palabra correcta es, se funde, y se transforma en agua líquida ocurren una serie de cambios en el sistema que no entiendes, mas sin embargo, tu puedes beber ese vaso de agua fría. Caso similar ocurre cuando sometes a calentamiento un recipiente de agua, puedes observar como los vapores salen de este y ascienden. O viceversa, que colocas en el refrigerador un jugo de fresa y lo olvidas y al cabo de unas horas es un sólido muy rígido. Estos son ejemplos de algunas transformaciones físicas de sustancias químicas. Pero más allá de solo observar el cambio de sólido a líquido, de líquido a gas o de líquido a sólido existen una serie de fenómenos asociados a estos cambios que muchos ignoran y me he dado a la tarea de mostrárselos.

Figura 1. Transformaciones físicas a b
Nuestras costumbres y observaciones nos han mostrado que a bajas temperaturas los sólidos son la fase de la materia más estable. A temperaturas más elevadas los líquidos predominan sobre los sólidos y a temperaturas mucho más altas son los vapores o gases quienes se encuentran en equilibrio. Pero cuales condiciones se deben mantener para poder establecer o conocer ¿Qué estado de la materia es el que estará presente? Estas son la temperatura y presión y se pueden graficar es los conocidos diagramas de fases para conocer las característica de la materia.
Un Sistema
Para comenzar debemos definir que es un sistema: Este es una parte del universo con características específicas y es nuestro objeto de estudio. Para los químicos este sistema puede ser una reacción química en algún recipiente de vidrio. Cada sistema tiene involucrado los alrededores, que son el resto del universo. Como se observa en la imagen siguiente.
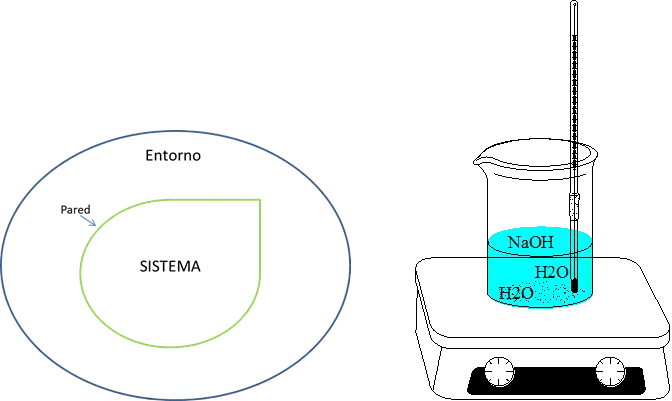
Figura 2. Sistema- Fuente: @viannis
Existen varios tipos de sistemas, los abiertos, los cerrados y los aislados. En los sistemas abiertos existe intercambio de materia y energía con el entorno. En los sistemas cerrados solo existe intercambio de energía en forma de calor, y en los sistemas aislados no existe ningún tipo de transferencia entre el sistema y sus alrededores todo esto se esquematiza en la figura 3.
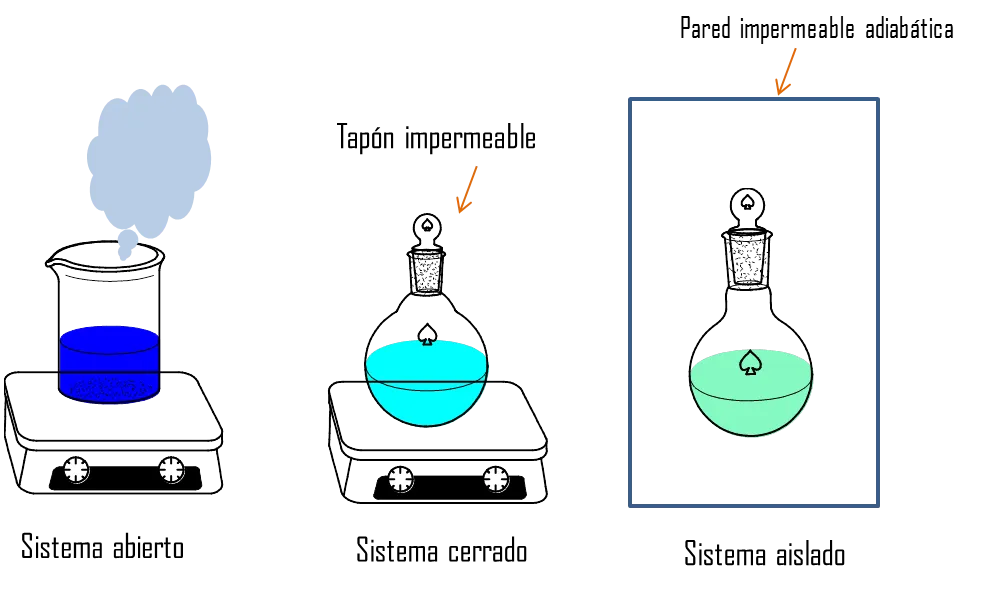
Figura 3. Tipos de Sistemas- Fuente: @viannis
De igual forma estos sistemas pueden clasificarse en sistemas homogéneos: son aquellos que están formado por una fase, es decir, que tiene el mismo valor de propiedades intensivas en cada una de sus partes. Y los sistemas heterogéneos: son los formados por dos o más fases. La definición de fase en un sistema es cualquier parte que contenga características específicas y separadas por límites. Por ejemplo una solución acuosa de cloruro de sodio sólido tiene dos fases: NaCl sólido y la disolución.
El concepto de fase no hace reseña a si es un sólido, líquido o gas. Un sistema puede ser líquido y tener más de una fase (por ejemplo: un sistema conformado por H2O y CCl4 tiene dos fases).
Para terminar de definir un sistemas debemos conocer que propiedades tiene, y estas son las Intensivas: que no dependen de la masa o del tamaño de un cuerpo, y las Extensivas: son aquellas que sí dependen de la masa o del tamaño de un cuerpo.
La condición de equilibrio
En un sistema cerrado en equilibrio termodinámico, el potencial químico, μ , de un componente dado es el mismo en todas las fases en las que el componente está presente. Este representa el cambio que ocurre en la energía de un sistema cuando este es alterado por otros componentes que son adicionados al equilibrio
 Ec 1
Ec 1 Estabilidad de las fases de una sustancia pura
El potencial químico μi de la sustancia i en un sistema de una fase está dado por la ecuación siguiente:
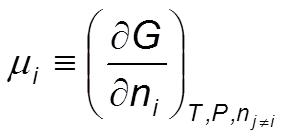 Ec 2
Ec 2 G=G(T,P,n1,n2…..), por tanto su derivada parcial δG/δni μies también función de estas variables de temperatura, presión y numero de moles. ni es una propiedad intensiva
El sistema más simple que puede existir solo consta de una fase y de un componente. Sea Gi (T, P) la energía de Gibbs molar de la sustancia i pura a la P y T del sistema. Como G es extensiva, se cumple que G=niGi (T,P).
Para una sustancia pura la ecuación de la energía de Gibbs es:
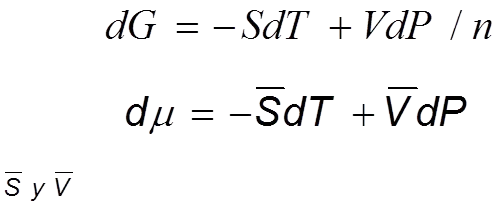 Ec 3
Ec 3 Según la tercera ley de la termodinámica, la entropía de una sustancia es positiva. Esto implica que (δ μ /δT ) P es siempre negativa. Por ende la gráfica de μ versus T a presión constante es una curva con pendiente negativa
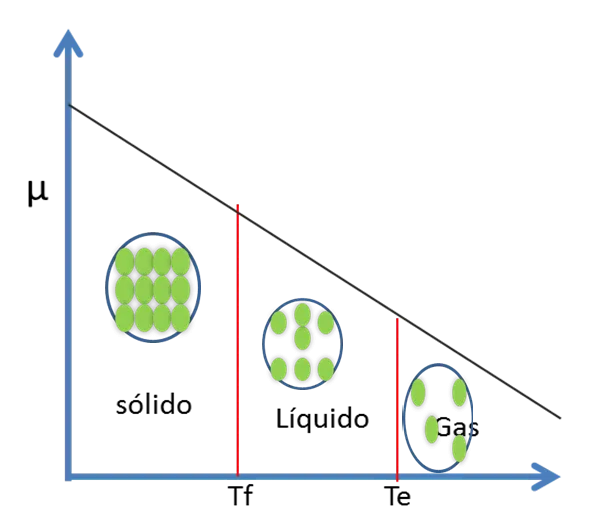
Figura 4. Potencial Químico de una sustancia versus la Temperatura- Fuente: @viannis
Si la T aumenta µ disminuye. Esto se debe a que el µ es una medida del equilibrio y en un gas se presentan movimientos caóticos de partículas por lo que el potencial disminuye.
Para las tres fases de una sustancia pura, se tiene
Sgas >> Slíquido > Ssólido
Esto lo que establece que en un gas su entropía es mucho mayor que en el líquido y a su vez este es mayor que en el sólido. La relación se puede apreciar en la figura 5. Al graficar μ vs T, la pendiente de la curva depende del valor de la entropía, S.
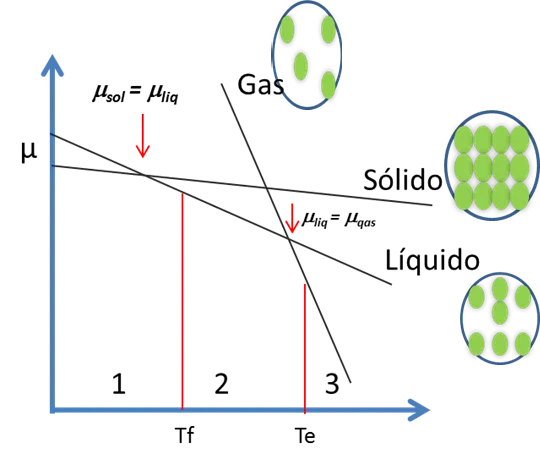
Figura 5. Potencial Químico de una sustancia versus la Temperatura- Fuente: @viannis
A una determinada presión, los estados sólido y líquido pueden coexistir en equilibrio cuando sus potenciales químicos son iguales μsol = μliq La temperatura correspondiente a este equilibrio es la de fusión Tf.
De forma análoga a una determinada presión, los estados líquido y gaseoso coexisten en equilibrio cuando μliq = μgas. La temperatura correspondiente a este equilibrio es la de ebullición, Te.
Dependencia de las curvas μ versus T con la presión
¿Qué pasa con las curvas si se modifica la presión?
Los potenciales químicos dependen de la P según la ecuación siguiente:
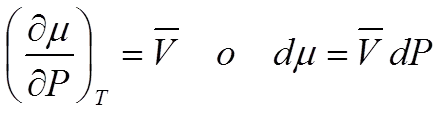 Ec 4
Ec 4 Si disminuye la Presión, disminuye proporcionalmente al volumen de la fase.
Como los volúmenes molares del líquido y del sólido son muy pequeños, el valor de μ disminuye muy poco como se muestra en la figura 6. Sólido (S): desde 1 hasta 2, Líquido (L): desde 3 hasta 4
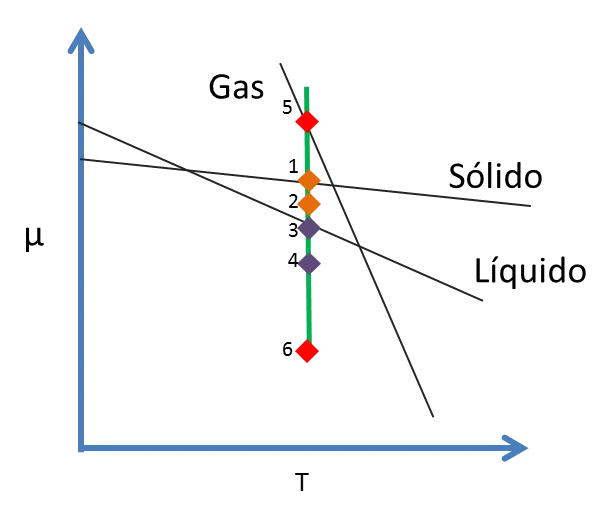
Figura 6. Potencial Químico de una sustancia versus la Temperatura- Fuente: @viannis
El volumen molar del gas es aproximadamente mil veces mayor que el del sólido o del líquido, por eso el μ del gas disminuye considerablemente desde 5 hasta 6.
Las curvas a presiones menores se indican en la siguiente figura 7 (líneas discontinuas)
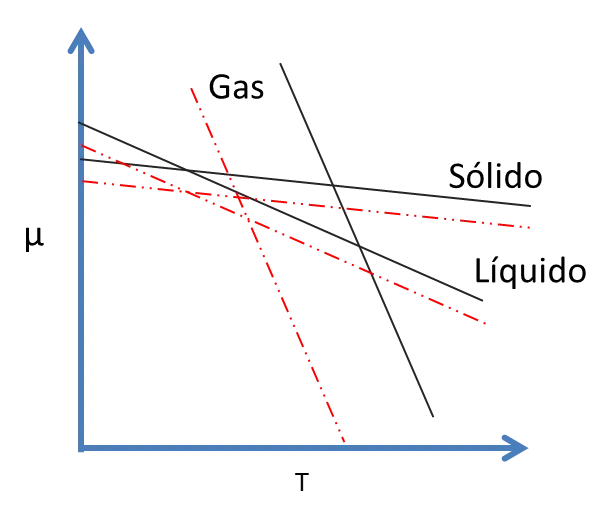
Figura 7. Potencial Químico. Efecto de la Presión en las Temperaturas- Fuente: @viannis
Como consecuencia de la disminución de presión, las temperaturas en el equilibrio se mueven de lugar. A presiones muy bajas, el intervalo de estabilidad de un líquido disminuye apreciablemente.
Entonces, no hay temperatura a la cual el líquido sea estable y el sólido tienda a sublimar. A la temperatura de sublimación, Ts, el sólido y el vapor coexisten en equilibrio y esto depende bastante de la presión.
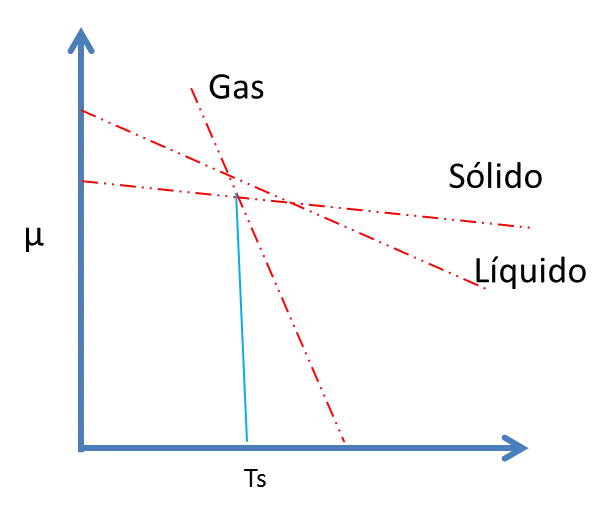
Figura 8. Temperatura de sublimación- Fuente: @viannis
Existe una serie de condiciones (presión) a la cual las tres curvas coinciden a la misma temperatura. Esta temperatura y presión definen al punto triple; donde las tres fases coexisten en equilibrio
Como ya se ha visto, las temperaturas de equilibrio dependen de la presión, ya que los puntos de intersección dependen de la presión. La ecuación de Clapeyron expresa la variación de la presión de equilibrio con la temperatura. Empleando esta ecuación, se puede representar de forma esquemática la presión de equilibrio en relación con la temperatura para cualquier transformación de fase.
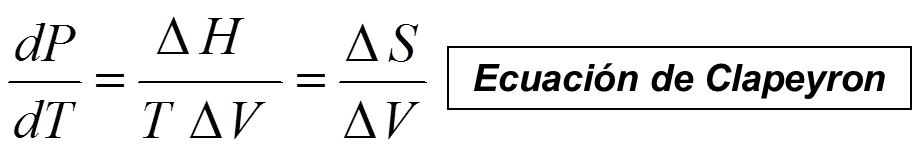 Ec 5
Ec 5 Siendo ΔS y ΔV los cambios de entropía y volumen correspondientes a la transición de fase β-α. Para la transición α-β, ΔS y ΔV tienen el mismo valor pero signo opuesto, y su cociente no cambia, por lo que no importa cuál sea la fase a la que llamamos α.
Un diagrama de fases es una representación gráfica de las temperaturas y presiones a la que una determinada sustancia es estable a estas condiciones. A continuación les mostrare los distintos diagramas de fases que se manejan en química.
Equilibrio Sólido-Líquido
Aplicando la ecuación de Clapeyron a la transformación sólido- líquido, se tiene
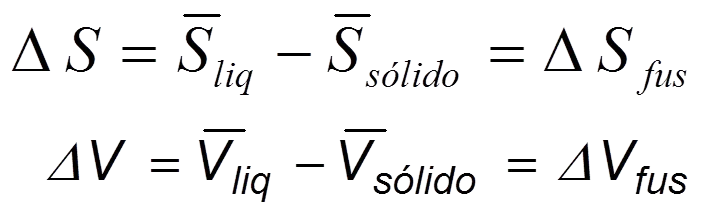 Ec 6
Ec 6 A la temperatura de equilibrio, la transformación es reversible, entonces ΔSfus = ΔHfus/T. La transformación de sólido a líquido siempre va acompañada de una absorción de calor, (ΔHfus es +); por tanto,
 Ec 7
Ec 7 La cantidad ΔVfus puede ser positiva o negativa, según la densidad del sólido sea mayor o menor que la del líquido:
 Ec 8
Ec 8 El inverso, dT/dP, es igual a ± 0,02 K /atm. Este valor muestra que un cambio de 1 atm en la presión altera la temperatura de fusión en algunas centésimas de kelvin.
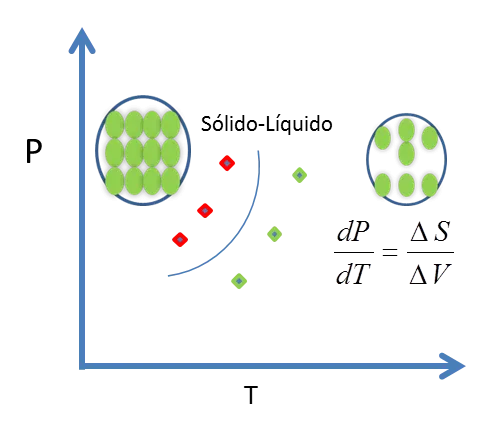
Figura 9. Línea de equilibrio Sólido-Líquido - Fuente: @viannis
Equilibrio Líquido-Gas
La aplicación de la ecuación de Clapeyron a la transformación líquido-gas da como resultado
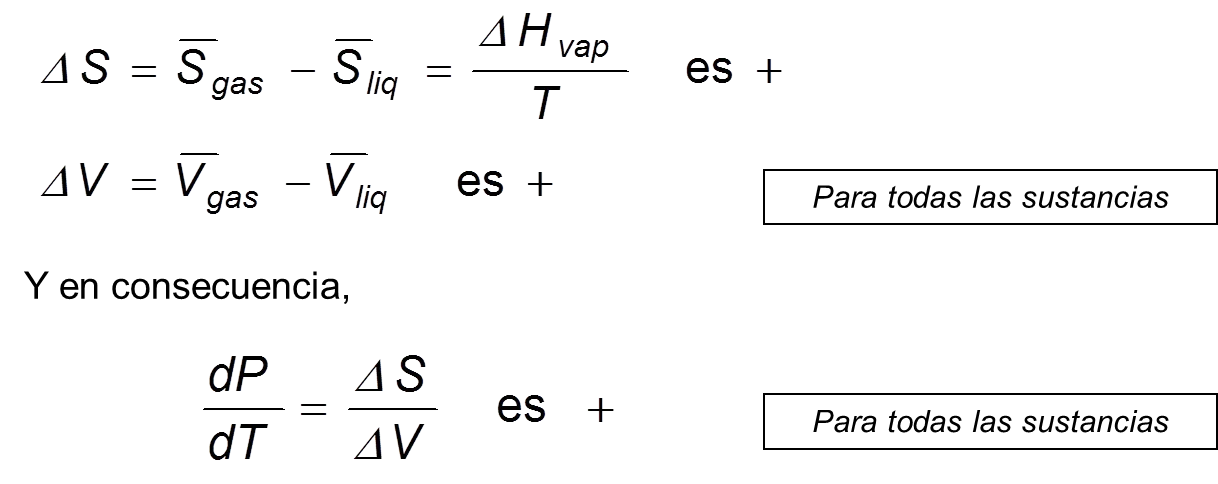 Ec 9
Ec 9 La línea de equilibrio líquido-gas siempre tiene una pendiente positiva. Sin embargo, el volumen molar del gas tiene una fuerte dependencia de T y P, lo que afecta el valor de ΔV. La pendiente de la curva líquido-gas es pequeña comparada con la de la curva sólido-líquido.
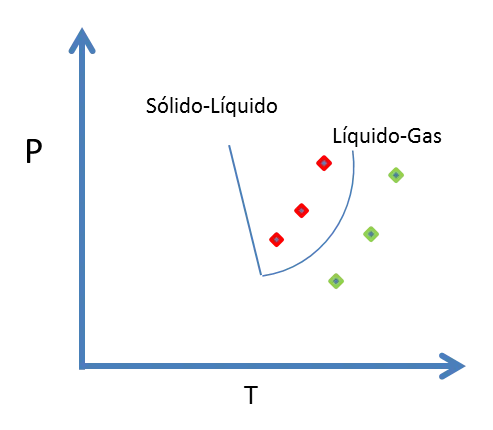
Figura 10. Línea de equilibrio Líquido-Gas - Fuente: @viannis
La curva líquido-gas representa los puntos donde el líquido y el gas coexisten. Los puntos a la izquierda de esta, están por debajo de la temperatura de ebullición y son condiciones en las cuales el líquido es estable. Los puntos a la derecha de la curva son condiciones a las cuales el gas es estable.
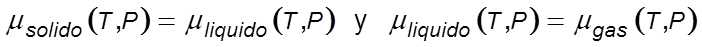 Ec 10
Ec 10 Equilibrio Sólido-Gas
Para la transformación sólido-gas, se tiene:
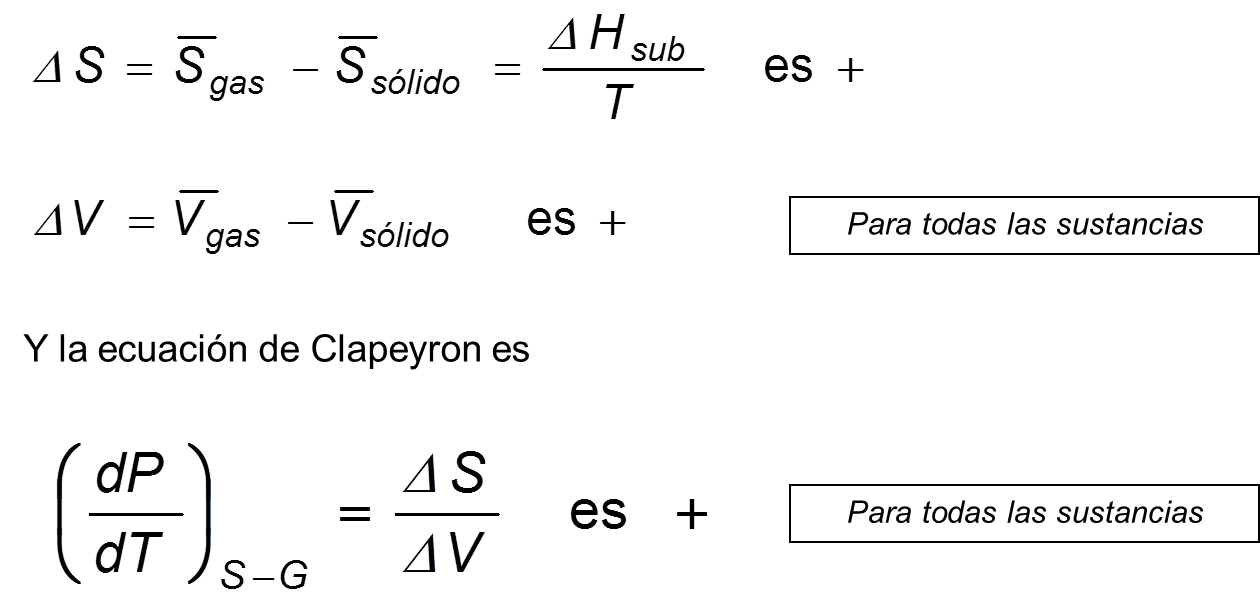 Ec 11
Ec 11 La pendiente de la curva Sólido-Gas es mayor en el punto triple que la pendiente Líquido-Gas.
Como ΔHsub = Δfus + ΔHvap , entonces
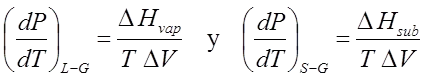 Ec 12
Ec 12 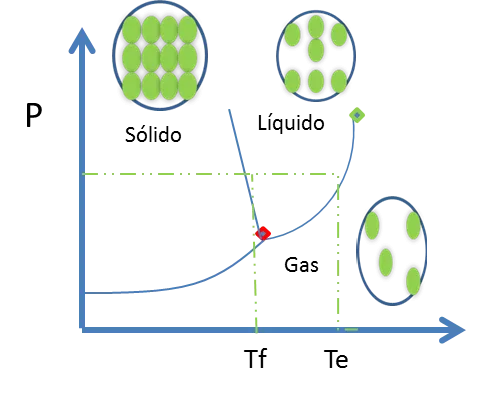
Figura 11. Diagrama de fase para una sustancia pura- Fuente: @viannis
Los puntos en la línea azul que representa el equilibrio Gas-Sólido correspondiente a las T y P. Todos los sitios a la izquierda del diagrama corresponden a temperaturas debajo de la sublimación y esto quiere decir que el sólido es estable. Los sitios a la derecha de esta curva muestran las condiciones donde el gas es estable. Esta nueva línea también coincide en un punto con las curvas líquido-gas y sólido-líquido.
Leer un diagrama de fases de cualquier sustancia es sencillo. Por ejemplo las regiones de una fase son las superficies abiertas de la figura anterior. A lo largo de las líneas azules (punto rojo) se encuentran 2 fases en equilibrio. Existe una temperatura y presión crítica, donde no es posible distinguir entre el líquido y gas por arriba.
Las líneas horizontales espaciadas, simbolizan una P constante, las temperaturas de fusión y ebullición son los interceptos con la línea horizontal con las curvas Sólido-Líquido y Líquido-Gas
La temperatura de ebullición de un líquido a una P1, es la temperatura a la que su presión de vapor de equilibrio se iguala a P1. La temperatura de ebullición a P1 corresponde a la temperatura máxima a la que el líquido puede existir a esa P.
La temperatura a la que el sólido y el líquido están en equilibrio a una determinada presión se conoce como Punto de fusión.
El punto triple es conocido como las condiciones de presión y temperatura donde los tres estados de una sustancia pueden coexistir en equilibrio termodinámico. El punto triple del agua es la referencia. Esto es a T=273,15 K y P=4,584 torr
Es posible representar cualquier estado de un sistema mediante la asignación de un punto en un diagrama de fases de P frente a T. como el de la figura 12.
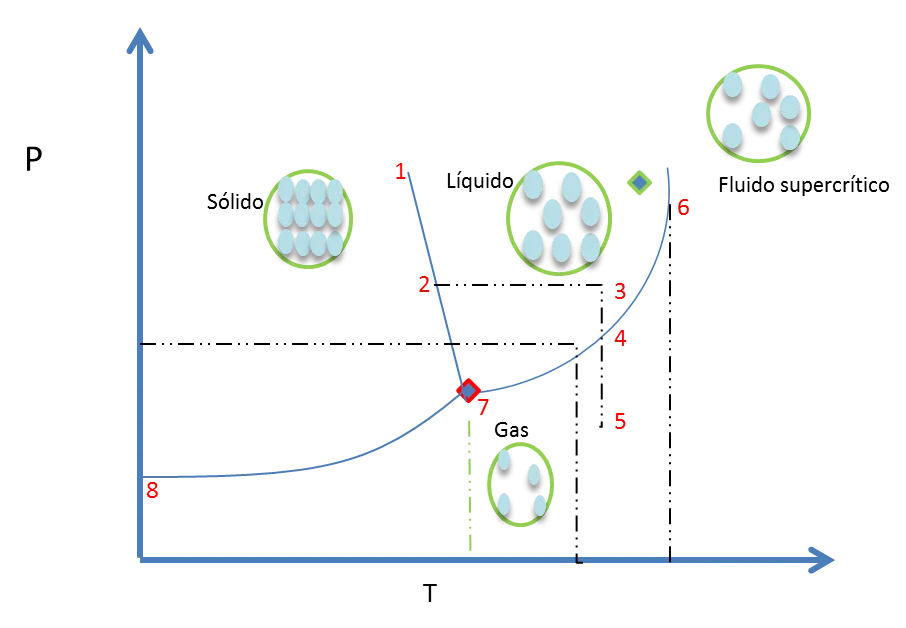
Figura 12. Diagrama de fases de una sustancia pura (agua)- Fuente: @viannis
Los fenómenos que les mencione al principio, (Fusión del hielo, evaporación del agua, solidificación de un líquido, sublimación de un sólido) son representados en un diagrama como el anterior. A continuación les explicare como se leen este tipo de gráficos.
A lo largo de la línea 8-7 existe equilibrio entre el sólido y el vapor. En el Punto 5 se encuentra en equilibrio el H2O gaseosa.
Subiendo desde el punto 5 al punto 4 ocurre un ligero aumento en la presión, mientras la temperatura esta constante. El sistema persiste gaseoso hasta que llega a una presión donde el vapor condensa hasta el estado líquido. En el punto 3 donde todo el gas condensó y la fase estable es la líquida.
Del punto 3 al punto 2 se enfría el sistema a una presión constante como resultado se tiene que el líquido comienza a solidificarse al alcanzar la temperatura de congelación. Donde ahora la fase que se encuentra estable es el sólido, (Hielo).
Partiendo del punto 4, donde preexiste un equilibrio entre las fases líquida y gaseosa, y se aumenta la T. El equilibrio del sistema se aleja del punto 4 a lo largo de la línea L-G hacia el punto 6. En la fase líquida disminuye su densidad debido a la expansión térmica del líquido y la densidad del gas crece por el veloz incremento de la presión de vapor del líquido con T. El punto 6 es el mencionado punto crítico de la sustancia donde las densidades de L y G se emparejan y ya no son 2 fases sino una. La figura 13 representa este punto del diagrama de fases.
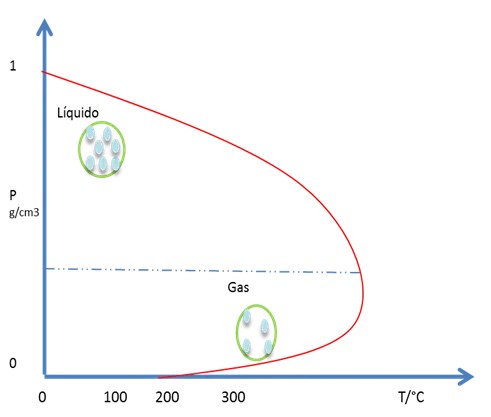
Figura 13. Temperatura y presión critica- Fuente: @viannis
Diagrama De Fases Del Carbono
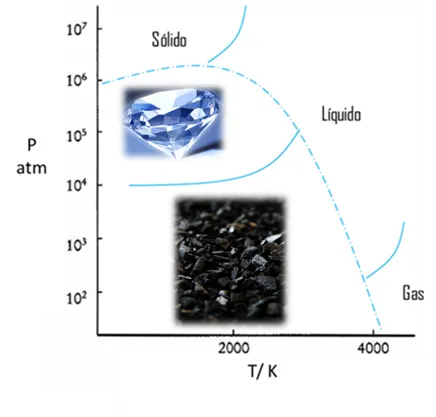
Figura 14. Diagrama de fase del carbono- Fuente: @viannis
A P atm, el carbono gaseoso es la fase estable a T > 4000 K.
Para obtener carbono líquido es necesario trabajar a ~4000 K y ~30 atm, o a ~1300 K y ~1.106 atm
En la síntesis comercial de diamantes la velocidad de conversión es un factor importante, por esta razón, se agrega un catalizador, ocurriendo la conversión a 70 Kbar y 230 K, condiciones alcanzables (el cambio de grafito puro a diamante ocurre a T~4000 K y P > 200 Kbar).
Con este ultimo ejemplo se puede entender como el común grafito se puede transformar en el mas bello diamante con el aumento de la presión y la temperatura. Es importante que sepan que la estructura química de estos dos materiales es la misma.
Si te gusto este post y quieres seguir leyendo articulo de calidad te invito a nuestra etiqueta científica de habla hispana #Stem-espanol y si quieres pertenecer a nuestra comunidad puedes entrar al canal de Discord e interactuar con personas con muuuucho conocimiento científico por compartir.
Referencias
Fisicoquímica - Ira Levine - quinta edición 2004 Volumen 1.
Fisicoquímica - Gilbert W. Castellan 2ª Edición
Fisicoquimica, 6ta edicion peter william atkins