Hola querida y estimada comunidad científica de #Stem-espanol y #Steemit en general. En las últimas semanas me encontré realizando un trabajo de investigación un tanto interesante y con muchas aplicaciones industriales. Quise indagar en el mundo del quitosano, un polímero con numerosas propiedades químicas y de fácil obtención debido a que proviene de un desecho de la industria alimenticia de los mariscos que normalmente termina en los lagos, ríos y mares como contaminación.
La quitina es un biopolímero de la clase de los polisacáridos proveniente del monómero 2-acetamido-2-deoxi-β-D-glucosa. Este compuesto es de apariencia blanca y dura, y es considerada una contaminación en los sitios marinos. De este monómero procede el quitosano. Tanto la quitina y el quitosano poseen un alto contenido de nitrógeno aproximadamente 8 % característica que los hace importante comercialmente. Además son recomendados como probables sustituyentes de los polímeros sintéticos debido a que estos tienen marcadas propiedades entre las que se destacan una nula toxicidad son biocompatibles, y biodegradable.
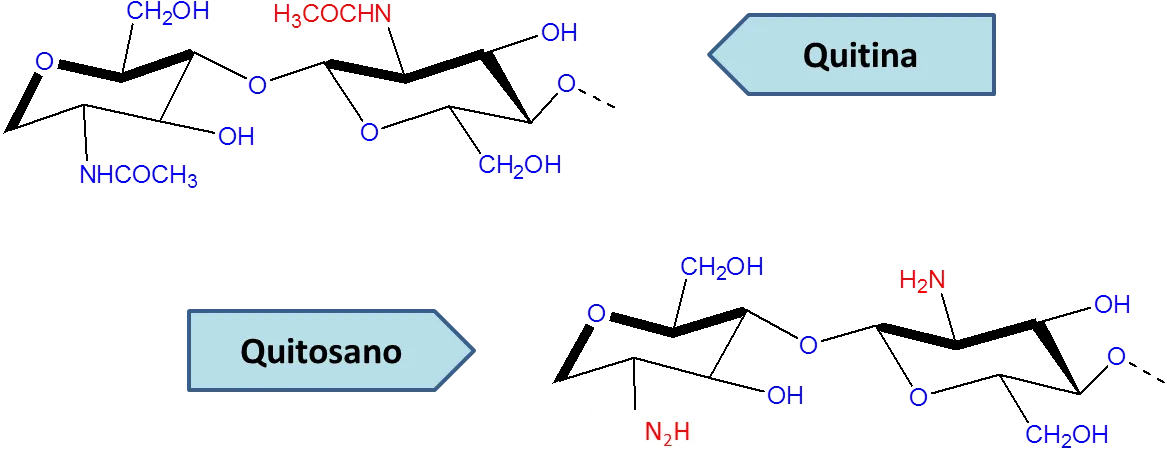 Estructura química de la quitina y quitosano- Fuente: Elaboración propia
Estructura química de la quitina y quitosano- Fuente: Elaboración propia La quitina se encuentra en abundancia en los exoesqueletos de los crustáceos y se puede obtener por un tratamiento químico. El quitosano es una transformación química de la quitina, bueno, tal vez menos que una transformación seria como una ligera modificación. Al hacer reaccionar la quitina con una solución álcali a altas temperaturas. El pH del polímero es altamente básico porque posee un grupo amino libre en su estructura, (NH2) esto le confiere algunas características químicas y físicas de gran interés industrial.
En este trabajo de investigación nos propusimos sintetizar quitosano con varios fines, uno es estudiar sus propiedades fungicidas en algunas frutas y hortalizas, para observar si alarga sus tiempos de vida útil y comercial. Por otro lado tratar de explicar cómo inhibe la vida de los microorganismos que provocan el envejecimiento de las mismas. Para esto utilizamos exoesqueletos de cangrejo azul que fueron recolectados en una industria marisquera del estado Zulia-Venezuela.
 A. Cangrejo azul-Referencial, B. Elaboración propia
A. Cangrejo azul-Referencial, B. Elaboración propia Metodología aplicada y herramientas utilizadas.
Materiales
• Tamices.
• Vasos de precipitados.
• Termómetros.
• Balones aforados.
• Cilindros graduados.
• Vidrios de reloj.
• Agitadores magnéticos.
• Varillas de vidrio.
Reactivos
• HCl (Riedel de Haën).
• NaOH (99%, MERCK)
• CH3COOH ácido acético (99,9%, Merck)
Equipos
• Molino para los desechos.
• Balanza digital analítica.
• Planchas de calentamiento con agitación.
• Espectrómetro infrarrojo con Transformada de Fourier (FTIR).
• Campana de extracción de gases
Procesos para la obtención de quitina y quitosano.
1. Acondicionamiento de la materia prima.
Los caparazones se deben lavar y triturar para obtener unas partículas uniformes de estas. En la figura siguiente muestro como quedo la materia prima luego de este proceso.

Triturado de los caparazones- Fuente: Elaboración propia
2. Desproteinización.
Para eliminar las proteínas que quedan en los caparazones se toman 50 gramos de desecho de la industria cangrejera en un beaker con 100 mL de una solución de NaOH al 10 %, se calienta durante 1 hora a una temperatura de 80 °C, luego se lava, filtra y se separa el sólido obtenido, el líquido se descarta luego de neutralizarse.

Proceso de Desproteinización. Fuente: Elaboración propia
3. Desmineralización.
El sólido obtenido de la parte anterior, es colocado en un beaker con 300 mL de agua, con una cantidad de HCl equivalente a los minerales del desecho, (esto se obtiene agregando el ácido hasta que desaparezca la efervescencia en el beakers), se lava, filtra y se separa el sólido obtenido, el líquido se descarta luego de neutralizarse para evitar la contaminación de las aguas servidas.
En la desmineralización se remueven sales de carbonato de calcio (CaCO3) y fosfato de calcio (Ca3(PO4)2) y otros minerales presentes en el exoesqueleto.

Proceso de Desmineralización- Fuente: Elaboración propia
4. Desacetilación.
Los sólidos provenientes del paso anterior (los cuales corresponden a la quitina,) se hace reaccionar con NaOH al 50 % a una temperatura de 100-105 °C durante 4 horas, este proceso se repitió 3 veces más, hasta la obtención de quitosano.
En este paso es que ocurre la reacción química de desacetilación de la quitina. Donde sucede una hidrólisis alcalina en la que el ion hidróxido, un nucleófilo fuerte, ataca a los grupos acetamida presentes en el carbono beta mediante un mecanismo de adición–eliminación nucleófila, para generar el quitosano como se muestra en la figura siguiente.
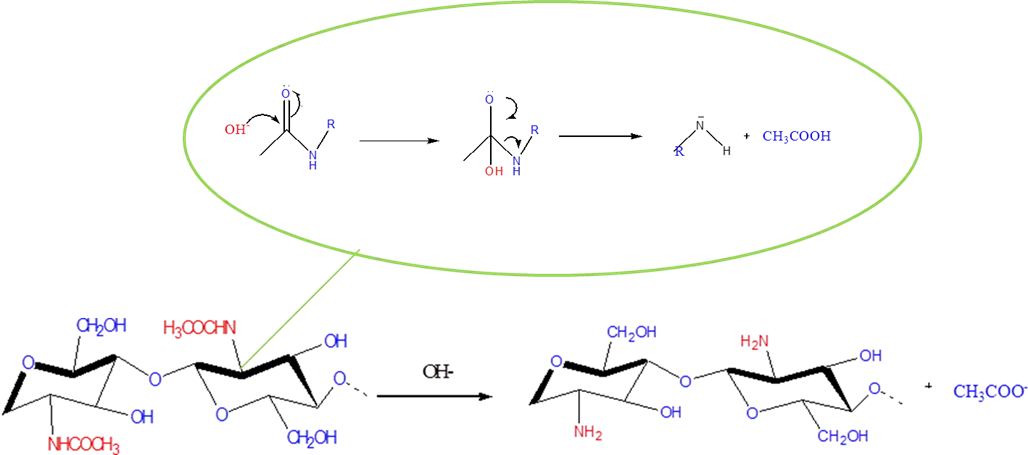
Mecanismo de reacción de la Desacetilación de la quitina para obtener quitosano Fuente: Elaboración propia

Proceso Desacetilación. Fuente: Elaboración propia
Prueba de percepción para determinar quitosano
Se agregó una pequeña cantidad (aproximadamente 1 g) de quitosano en un beaker con 10 mL de ácido acético. Luego de 10 minutos y con agitación manual se agregó 40 mL de agua y se esperó 5 minutos. Si la prueba es positiva las hojuelas de quitina (de color blanco) se hidratan, se hinchan y se tornan transparentes. Fenómeno que ocurrió en este proceso, comprobando que la síntesis fue exitosa. Pero como químicos no podemos conformarnos con una percepción nada más, todo producto de una reacción debe caracterizarse espectroscópicamente para estar completamente seguros.
Caracterización de quitosano por Espectroscopia de Infrarrojo con Transformada de Fourier (FTIR).
Los espectros se tomaron elaborando pastillas de KBr (mezclando quitosano con KBr seco).
El grado de desacetilación se define como el contenido o cantidad relativa de grupos aminos presentes en la cadena polimérica. En esta investigación se obtuvo quitosano con porcentajes de desacetilación DD entre el 80-99 %, empleando el método de Brugnerotto y col. El cual el utiliza las bandas secundarias de absorción en 1420 cm-1 y 1320 cm-1 del grupo amina y acetamida del quitosano, y es determinado por medio de la siguiente fórmula:
A1320/A1420= 0.3822 + 0,03133*DA
En la figura siguiente se puede observar el espectro FTIR de quitosano donde se presentan bandas de los grupos funcionales característicos de la molécula de quitosano, evidenciándose la aparición de la banda del grupo amino (N-H) a 1595 cm-1, a 1660 cm-1 aparece la tensión por vibración del C = O, a 1629 cm-1 se ve la frecuencia de torsión –NH2, a 1.424 cm-1 la torsión –CH2–, a 1326 cm-1 la tensión C–N. En lo que respecta a las bandas encontradas para la muestra, resultaron acordes a las características del quitosano.
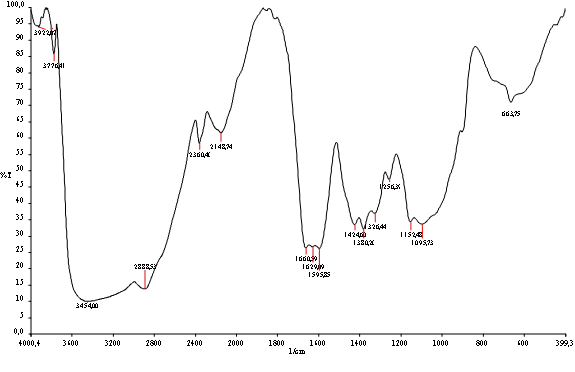
Espectro FTIR de quitosano obtenido Fuente: Elaboración propia
La gran banda cerca de 3000 se debe a que la muestra se encontraba aun muy húmeda-
Discusión de los resultados
El tamaño debe ser uniforme y no mayor de 0,5 cm para garantizar la eficiencia en el proceso de desproteinización con NaOH a elevadas temperaturas. En la desmineralización se remueven sales de carbonato de calcio (CaCO3,) y fosfato de calcio (Ca3(PO4)2) y otros minerales presentes en el exoesqueleto.
La desacetilación se realizó a altas temperaturas para aumentar reactividad debido a la configuración trans de los sustituyentes acetamida con respecto al grupo OH unido al átomo de C(3) del anillo, la presencia de puentes de hidrógeno entre los grupos hidroxilo y carbonilo y amida de cadenas adyacentes; y porque el empaquetamiento de las cadenas en la quitina, que previene el acceso del álcali a los sitios reactivos.
En la tabla 1, se observan las áreas y el grado de desacetilación obtenido. El grado de desacetilación fue determinado mediante el método de Bruggneroto y col. (3)
| Muestra | Área 1320 cm-1 | Área 1420 cm-1 | DD |
| Quitosano 1 | 1,98 | 4,72 | 99 % |
| Quitosano 2 | 1,89 | 4,62 | 80 % |
| Quitosano 3 | 1,93 | 4,70 | 95 % |
Dispersiones finales
En este trabajo, se logró alcanzar las condiciones apropiadas para obtener quitosano utilizando los exoesqueletos de cangrejo de la variedad de cangrejo azul (Callinectes sapidus) y se empleó espectrometría de infrarrojo con Transformada de Fourier (FTIR) para su caracterización. El proceso para la obtención de quitosano se realizó a partir de la quitina proveniente de los desechos de la industria cangrejera. Este requiere de varios pasos fundamentales como son: la desproteinización de los exoesqueletos con NaOH al 10%, la desmineralización para la cual se utilizó HCl y por último la hidrólisis termoalcalina de los grupos acetamida de la quitina con NaOH al 50% (desacetilación).
El quitosano obtenido fue caracterizado mediante FTIR y se observaron las bandas de los grupos funcionales correspondientes a la molécula como la tensión N-H a 1595cm-1, del grupo amino y 1629 cm-1, del grupo acetamida (amida I). El grado de desacetilación calculado estuvo entre de 80-99 %.
Esta investigación actualmente está en curso. Para estudiar las propiedades fungicidas del material obtenido. Se han seleccionado una serie de frutas y hortalizas que están cubiertas con una solución de agua/quitosano y evaluando los tiempos de vida de las frutas. Mientras esto, está en observación decidí publicar este post para ir orientando en el área. En el próximo artículo subiré fotos del proceso y cómo evoluciona la vida de estas especies.
Referencias
Felse PA, Panda T “Studies on applications of chitin and its derivatives”, Bioprocess Engineering, 20,505 (1999)
Kurita K “Chitin and chitosan: Functional biopolymers from marine crustacean”, Marine Biotechnology mini–review, 8, 203 (2006)
Brugnerotto J, Lizardib J “An infrared investigation in relation with chitin and chitosan characterization”, Polymer, 42, 3569 (2001)
Aranaz, I.; Mengíbar, M.; Harris, R.; Paños, I.; Miralles, B.; Acosta, N.; Galed, G.; Heras, Á., 2009,“Functional Characterization of Chitin and Chitosan”, Current Chemical Biology, 3, 203–230