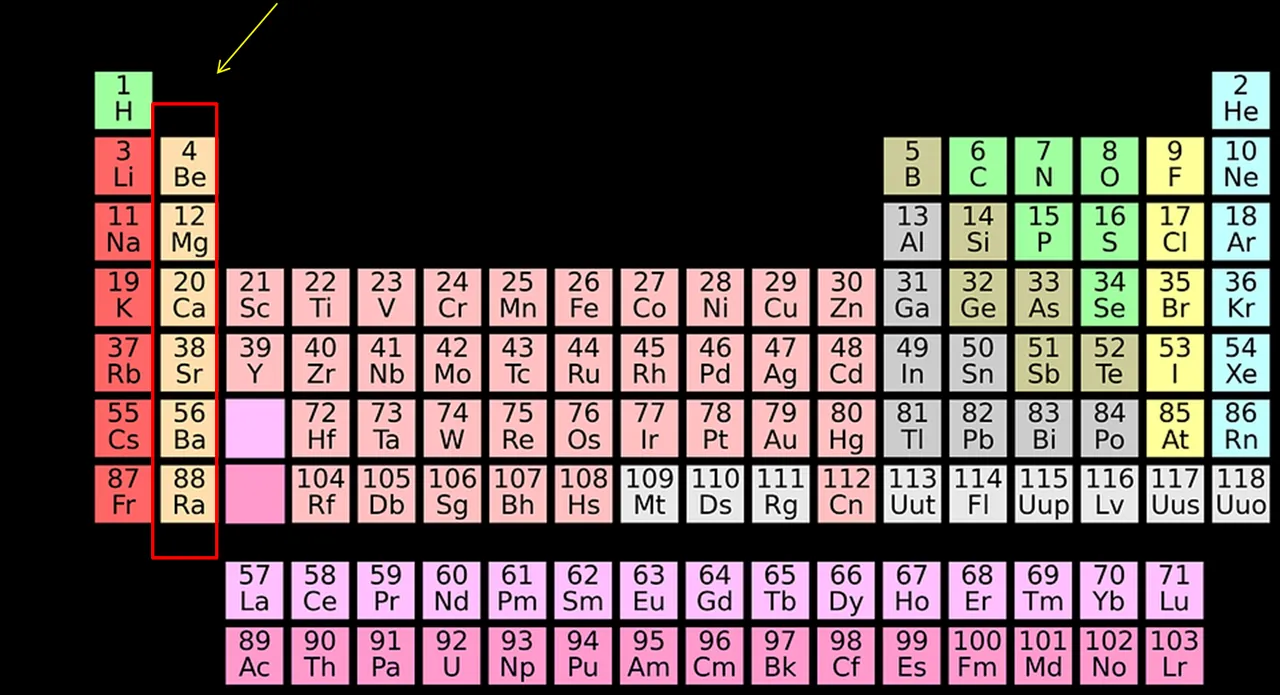
Introducción
La tabla periódica está constituida por todos los elementos que conforman nuestro planeta tierra, y se encuentra organizada de manera tal que los elementos se agrupan de acuerdo a sus características similares. El grupo 2 de la tabla periódica es conocido como la familia de los alcalinotérreos, y está formada por el berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Estos elementos tienen 2 electrones en su última capa de valencia que están muy disponibles para ser donados y formar enlaces iónicos con otros elementos de la tabla periódica como los halógenos.
El nombre de alcalinotérreos se origina desde la época de los alquimistas (los primeros químicos de la historia), ellos llamaban tierra a cualquier sustancia sólida que no se solubilizaba en el agua y no se destruía con el fuego. Además de que la cal (CaO) y la magnesia (MgO) que son las tierras conformadas por los elementos de este grupo dan reacciones alcalinas, es decir, con pH superiores a 8.
Estos elementos son catiónicos incoloros que no son fácilmente hidrolizables en soluciones acuosas menos el Berilio. Y tienen las características de que reaccionan con el hidrógeno, oxígeno, carbono, azufre y otros metales. El tamaño de los átomos de este grupo va aumentando de arriba hacia abajo igual que el radio iónico.
Entre las características de ellos es que son metales sólidos grisáceos o blancos, blandos y excelentes conductores eléctricos con puntos de ebullición y fusión muy altos. Poseen un alto potencial de oxidación que crece a medida que se asciende en el grupo, es decir, que el poder reductor aumenta desde el berilio al radio. Todos estos elementos potentemente electropositivos, como lo señala su alta reactividad química.

Calcio Magnesio Berilio Estroncio Bario
Continuando con la misma línea de investigación de mis últimas publicaciones donde les muestro las propiedades y características de los elementos que constituyen la tabla periódica en esta oportunidad les mostraré como caracterizar las propiedades de los elementos del grupo 2 (IIA) a través de métodos de laboratorio.
Metodología Desarrollada y Resultados Obtenidos
1 Reactividad del Magnesio (Mg) y Calcio (Ca) en Agua.
Procedimiento
En una gradilla se colocaron dos tubos de ensayo, en ambos se adicionó agua destilada, y posteriormente la fenolftaleína como indicador, luego se tomó un trozo de magnesio en cinta, y fue agregado al primer tubo de ensayo con posterior calentamiento para así observar la reacción resultante. Luego se realizó el mismo procedimiento para el calcio (Ca), utilizando segundo tubo de ensayo.
Al agregar la cinta de magnesio al agua fría con fenolftaleína, no ocurrió ningún cambio, al suministrarle calor al tubo de ensayo se observó la mudanza de color tornándose rosa pálido la solución, identificándose así la formación del hidróxido de magnesio. Para la unión entre el Mg y agua se manifiesta la siguiente reacción [1]:
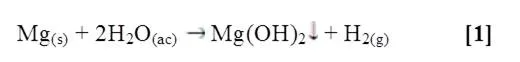
En el caso del calcio, al agregarlo al agua fría hubo una reacción con el indicador, se dio el cambio de color característico de la presencia del medio alcalino. Para la unión entre calcio y agua se presenta la siguiente reacción [2]:
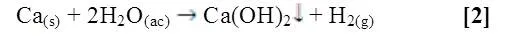
En este grupo todos los elementos presentan una carga (+2), mientras que el radio atómico aumenta en orden creciente del Berilio (Be) al Radio (Ra). En este mismo sentido incrementa su actividad reductora y su reactividad, disminuyendo su energía de ionización y a medida que el potencial estándar se vuelve más negativo, la espontaneidad, o la tendencia a que suceda la reacción redox es mucho mayor. Así mientras que el Calcio (Ca), Estroncio (Sr) y Bario (Ba) reaccionan fácilmente con agua fría, el Berilio (Be) y Magnesio (Mg) reaccionan solo con agua caliente.
2 Disolución de Magnesio (Mg) y Calcio (Ca) en Ácido Clorhídrico (HCl).
Procedimiento
Se preparó una solución de ácido clorhídrico (HCl) 0,1 M, luego se adicionó una porción (2 mL aprox.) en un tubo de ensayo, al mismo se le agregó un trozo de magnesio en cinta observándose la reacción resultante. Posteriormente se realizó el mismo procedimiento para el calcio (Ca).
Al entrar en contacto el Ca y el Mg con HCl diluido se observó que ambos reaccionaron, el calcio reaccionó lentamente, no se observó un cambio de color en la solución y no se notó un desprendimiento de gas [4]. El magnesio reaccionó de forma espontánea apreciándose un burbujeo constante de color blanco con un desprendimiento notable de gas [3].
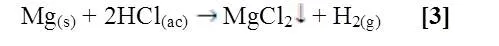
El magnesio reacciona con ácido clorhídrico produciendo calor e hidrógeno, que se libera al ambiente en forma de burbujas. A altas temperaturas la reacción ocurre aún más rápido.
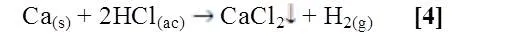
El elemento calcio es poco soluble en el ácido, o en su defecto la reacción es muy lenta por lo que no se puede apreciar la reacción instantáneamente. Entonces se obtiene una reacción espontánea, que según la literatura es por el valor negativo de la energía libre de Gibbs.
3 Calcinación del Magnesio (Mg) e Hidrólisis del Producto.
Procedimiento
Se tomaron 2 tubos de ensayos a los cuales se le adiciono agua destilada, seguidamente se expuso a la llama de un mechero un trozo de magnesio en cinta, el producto resultante se hidrolizó en el primer tubo, agregando unas gotas de fenolftaleína para observar cualquier cambio producido, se repitió la experiencia utilizando el segundo tubo de ensayo pero variando la fenolftaleína por el reactivo de Nessler.
En esta experiencia, al calentar la cinta de magnesio se pudo observar una llama blanca muy intensa y al hidrolizar dicho compuesto se notó un cambio de color de la cinta en presencia de fenolftaleína como indicador, al repetir la experiencia pero empleando el reactivo de Nessler se logró evidenciar la presencia de amoniaco en la solución ya que la misma se tornó naranja.
La cinta de magnesio al calentarse a altas temperaturas arde al estar en contacto con el oxígeno del aire, produciendo una llama brillante muy intensa, luego de esto las características de la cinta cambian debido a la producción de óxido de magnesio (MgO) [5]. Al agregar dicho oxido producido en agua con indicador (fenolftaleína) y calentándose se produce un cambio de color debido a la producción de hidróxido de magnesio (Mg(OH)2) (Figura siguiente) [6], ya que se sabe que dichos óxidos de metales alcalinotérreos reaccionan con agua formando sus respectivos hidróxidos, si la concentración de la base (Hidroxilos) es grandes el hidróxido de magnesio precipita.(6)
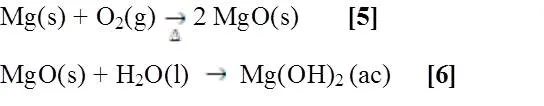

Figura 1. Presencia de hidróxido de Magnesio en la calcinación e hidrólisis del Magnesio.- Fuente:@VianniS
Existe una segunda reacción entre la cinta de magnesio y el nitrógeno del aire, formándose nitruro de magnesio (Mg3N2) [7], al hidrolizar dicho compuesto se produce hidróxido de magnesio y amoniaco [8].
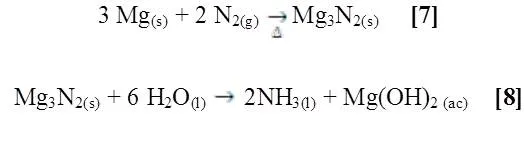
Para comprobar lo antes mencionado, se emplea el reactivo de Nessler a dicha disolución para observar la presencia de amoniaco (NH3) o catión amonio (NH4+), si la segunda reacción es correcta la solución se torna amarilla-naranja y en grandes concentraciones se forma un precipitado color naranja (Figura siguiente).
Nota: El reactivo de Nessler es una solución 0,09M de Tetrayodomercuriato (II) de potasio (K2[HgI4]) en una solución 2,5 M de hidróxido de potasio (KOH).
La reacción entre el reactivo de Nessler y el amoniaco procede de la siguiente manera:
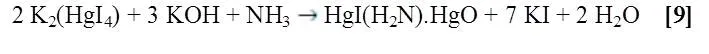
La reacción entre el reactivo de Nessler y el catión amonio procede de la siguiente manera:
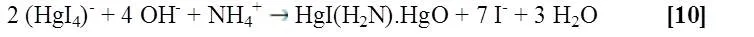

Figura 2. Presencia de Amoniaco en la calcinación e hidrólisis del Magnesio.-Fuente:@VianniS
La coloración observada es debido a los compuestos de mercurio producto de esta reacción.
4 Calcinación de la Tiza.
Procedimiento
Se tomó un trozo de tiza y se pulverizo con ayuda de un mortero, se dividió la cantidad de tiza pulverizada colocándose en dos capsulas de porcelana, a las cuales se les aplicó calor para así calcinar la tiza, terminada la calcinación se dejó enfriar por varios minutos y se adicionó una porción en un tubo de ensayo al que se añadió un poco de agua destilada y unas gotas de fenolftaleína, la experiencia se repitió pero añadiendo el agua gota a gota en el tubo con la porción de tiza calcinada y por último el indicador.
La tiza está compuesta en su mayoría por carbonato de calcio (CaCO3); el producto de descomposición térmica debido a la calcinación de este compuesto fue disuelto en agua y tratado con indicador (Fenolftaleína).
Estas observaciones pueden explicarse de la siguiente manera, mostrando estas reacciones [11]: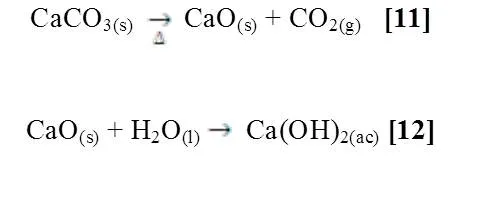
La reacción [11] muestra la descomposición térmica del carbonato de calcio produciendo oxido de calcio y dióxido de carbono gaseoso; el ∆G es positivo debido a la esta reacción no es espontánea y solo es posible aplicando gran cantidad de energía en forma de calor. Seguidamente al agregarse agua al oxido de calcio se demuestra la existencia del hidróxido de calcio [12] en solución debido a la coloración rosa de la solución al agregarse la fenolftaleína (Figura #3), se puede observar que el ∆G es negativo debido a la espontaneidad de la reacción.

Figura #3. Hidróxido de Calcio producto de una calcinación e hidrólisis de la tiza.-Fuente:@VianniS
5 Solubilidad de los Hidróxidos de los Metales Alcalinos.
Procedimiento
Se preparó una solución de hidróxido de sodio (NaOH), por otra parte se ubicaron las sales de cada metal alcalinotérreo, tales como: cloruro de berilio (BeCl2), cloruro de magnesio (MgCl2), cloruro de calcio (CaCl2) y cloruro de bario (BaCl2) para luego disponer de una gradilla con cuatro tubos de ensayos previamente rotulados. Con una espátula fina se incorporó a cada tubo la sal correspondiente y 1 mL de la solución preparada, donde al momento reaccionar se procedió a anotar las observaciones.
Al agregarle al NaOH a las respectivas sales sucedió lo siguiente:
• Para el BeCl2 está sal cambio de color amarillo a unos pequeños gránulos de color blanco correspondiente al Be(OH)2 formado que precipitó [12].
• En el caso del MgCl2 esta sal se disolvió formándose una solución blanquecina y un precipitado correspondiente al Mg(OH)2 formado [13].
• El CaCl2(ac) formó una solución blanca [14].
• Por último, el BaCl2 formó una disolución blanca densa [15].

Figura#4. Solubilidad de los Hidróxidos de los Metales Alcalinotérreos- Fuente:@VianniS
A continuación se presentan las reacciones que según la bibliografía están involucradas en el proceso
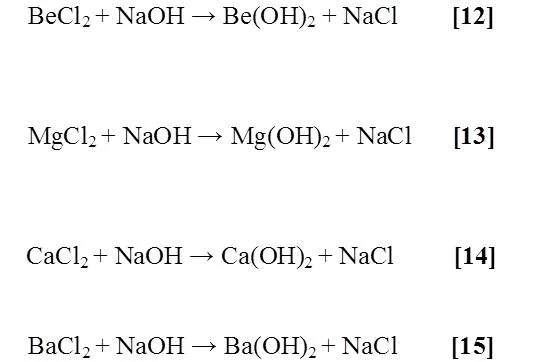
Estos resultados respaldan lo que teóricamente debe ocurrir, pues la solubilidad de los hidróxidos de los metales alcalinotérreos formados a partir de sus correspondientes sales aumenta con el tamaño del metal; ya que el anión OH- es pequeño, los hidróxidos van de insolubles a solubles al descender en el grupo. Debido a esto el Be(OH)2 se observó un precipitado porque el Be es el más pequeño y además tiene un Kps bastante bajo de 6,92x10-22 y el Kps aumentan a medida que se desciende en el grupo; Mg(OH)2 (Kps: 5,61x10-12), Ca(OH)2 (Kps: 5,4x10-6), Sr(OH)2 (Kps: 3,1x10-4) y Ba(OH)2 (Kps: 5x10-3); esto explica porque se fue observando cada vez menos precipitado hasta la formación de solamente una disolución densa.
Mostrándose en las siguientes reacciones el caso anfótero presente en el estudio
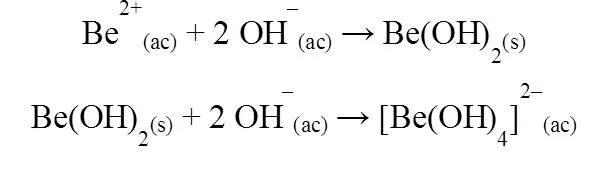
6 Coloración de la llama.
Procedimiento
En esta experiencia se tomó con una espátula una porción de cloruro de calcio (CaCl2) y de Bario (BaCl2), así como un trozo de magnesio en cinta (Mg), y se acercó cada metal a la llama de un mechero bunsen y se observó la coloración que presento la llama al estar en contacto con cada uno de ellos.
Se expusieron a la llama del mechero diferentes sales de los metales alcalinotérreos observando las diferentes coloraciones de la llama frente a estos compuestos (Figura #5):
• Emisión del Magnesio: Se observó un color blanco brillante muy intenso.
• Emisión de Cloruro de Bario: El color de la llama frente a esta sal fue amarillo verdoso.
• Emisión de Cloruro de Calcio: La llama se tornó de color rojo carmesí al exponer esta sal a la llama del mechero.

Figura #5. Coloración de la llama de los metales alcalinotérreos- Fuente:@VianniS
Al calentar los metales estos absorben calor, y al oxidarse deben liberar esta energía, y lo hacen en forma de ondas electromagnéticas, en algunos elementos estas ondas se encuentran dentro del espectro visible del ser humano y es por esta razón se da origen a los colores.
Teóricamente cuando los metales o sus compuestos, se calientan fuertemente a temperaturas elevadas, la llama adquiere colores brillantes que son característicos de cada metal. Los colores se deben a átomos del metal que han pasado a estados energéticos excitados debido a que absorben energía de la llama; los átomos que han sido excitados pueden perder su exceso de energía por emisión de luz de una longitud de onda característica. Los compuestos de estos elementos contienen a los átomos metálicos en forma de iones positivos en el estado sólido, no obstante, cuando se calientan a la elevada temperatura de una llama se disocia dando átomos gaseosos y no iones.
De acuerdo al diagrama de niveles de energía del magnesio se puede observar líneas verticales indicando algunas transiciones electrónicas habituales que siguen a la excitación de los átomos del magnesio acompañada de su longitud de onda de la radiación resultante. La línea a 4571 eV pertenecientes a la transición del nivel de energía 3p al nivel inferior 3s son las más intensas y las responsables del color blanco que se observa cuando se introduce magnesio o sales de magnesio en una llama. Puede observarse ya que entra en el rango de la luz visible que oscila entre los 400 y 700 nm.
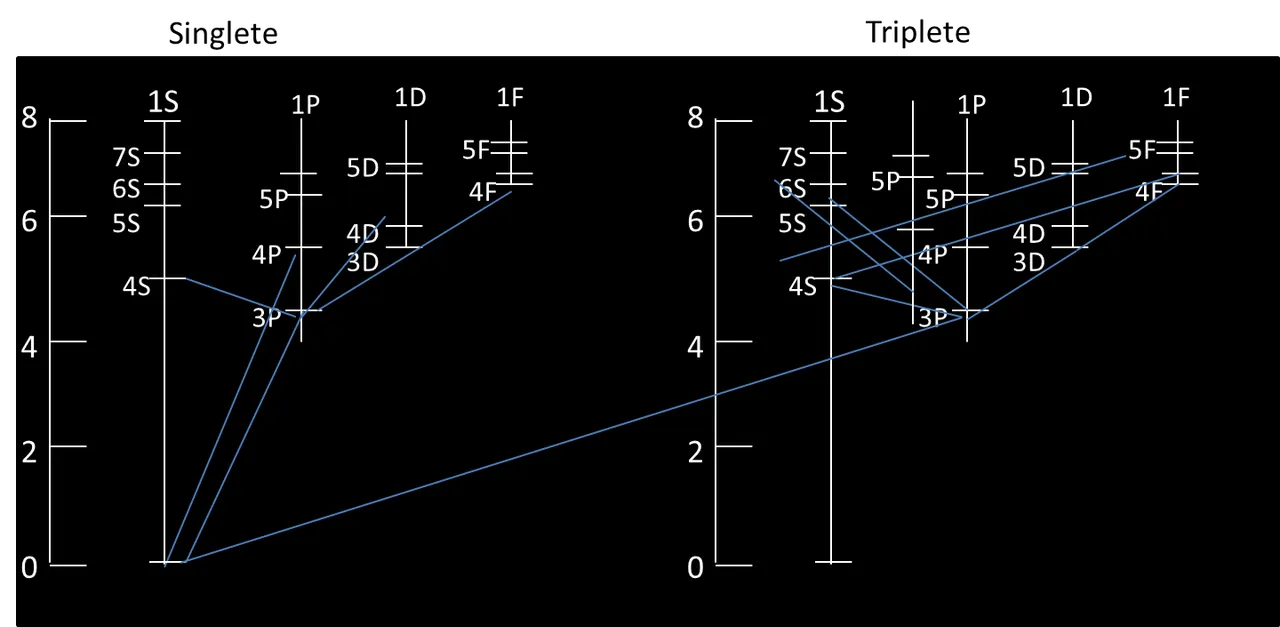
Figura #6: diagrama de niveles de energía del magnesio.- Fuente: @VianniS
En los casos de los metales alcalinos bario y calcio la energía de cada nivel depende de varios factores, entre los cuales los principales son: La carga nuclear, la distancia del electrón al núcleo y el electrón en cuestión. A mayor carga nuclear, menor separación entre el núcleo y el electrón y, en consecuencia, mientras más bajo sea el nivel atómico ocupado por el electrón, menor será su energía, por lo tanto la longitud de onda de la radiación resultante de su relajación será distinta en cada metal para el calcio es 6162 Ǻ y para el bario 5535 Ǻ proporcionándole los colores que fueron observados.
Disposiciones finales
• Se centraliza entonces que lo metales alcalinotérreos por la pérdida de electrones de valencia ns2, forman la especie M+2, que es la característica de su química, tanto en el estado sólido como en dilución.
• El Calcio, Estroncio y Bario tienden a reaccionar fácilmente con el agua fría, el Mg con agua caliente y el Be probablemente con el vapor de agua.
• La solubilidad de los hidróxidos va de insolubles a solubles al descender en el grupo. Esto debido principalmente al aumento del radio atómico y al descenso de la energía de ionización.
• Los compuestos de berilio muestran carácter covalente, además en disolución acuosa los metales alcalinotérreos están presentes también como iones dispositivos, M+2, donde el factor responsable es la entalpía de hidratación.
• Se observo altas energía exhibida por estos metales al exponerlos a la llama, debido a la excitación producida por los electrones de su última capa de valencia.
• Los colores de los metales a la llama se deben a que sus átomos han pasado a estados energéticos excitados debido a que absorben energía de esta. Cada elemento tiene su propio espectro debido a los diferentes colores o longitudes de onda de los cuantos de luz emitidos o absorbidos por un átomo o molécula.
Como de costumbre los invito a continuar leyendo publicaciones científicas de muy alta calidad en la etiqueta de #Stem-espanol y si te aminas a formar parte de esta comunidad en crecimiento puedes comenzar formando parte en nuestro canal de Discord. Nos veremos por allá. Y hasta mi próxima publicación
Referencias Bibliográficas.
- A.G. Sharpe. Química inorgánica. Editorial Reverté S.A. Madrid España. Pág. 275.
- Chang Raymond; Química. Novena edición, Editorial: MC. Graw Hill. México 2007.
- Cotton, A., Wilkinson, A., Química Inorgánica Avanzada. Editorial Limusa. México 1976.
- Shriver & Atkins. Química Inorgánica, cuarta edición. Editorial McGraw Hill. México 2006.
- Svehla, G. 1979. Vogel’s Textbook of Macro and Semimicro Qualitative Inorganic Analysis. Fifth edition, pág 285-287.
- Semishin, V. 1967. Practica de Química General Inorgánica. Editorial Mir, pág. 208-211.
- Huheey Jamas E., Keiter Ellen A., Keiter Richard L.; Química Inorgánica:
- Sienko, M.,Plane,R., Química. Séptima Edición. Editorial Aguilar. España. 1970.