Saludos queridos Steemians-Lectores. Saludos especiales a nuestra comunidad científica de #Stem-espanol.
Continuado con algunos estudios sobre las propiedades de los elementos que conforman nuestro planeta y que se encuentran organizados en la tabla periódica y con los que estamos asociados a diarios, les traigo una serie de experimentos que realice con el ánimo de mostrarles un poquito más sobre el maravilloso mundo químico que desconocemos.
Introducción.
El grupo quince (15) o VA de la tabla periódica está integrado por los elementos Nitrógeno N, Fósforo P, Arsénico As, Antimonio Sb y Bismuto Bi. La configuración electrónica correspondiente a estos elementos, muestra que tienen cinco electrones de valencia en su última capa, sin embargo, sus propiedades difieren desde el nitrógeno hasta al último. El carácter metálico aumenta conforme se baja por el grupo. Donde el nitrógeno es un no metal y un gas diatómico, El fósforo es un sólido negro mientras que el arsénico y antimonio son grises con características metálicas mientras que el bismuto es un metal pesado. Las temperaturas de fusión desde el arsénico para abajo disminuyen debido a que los enlaces covalentes van perdiendo su carácter con el aumento del carácter metálico.
El estado de oxidación más alto de este grupo es el +5 y esto se debe al compartimiento de electrones con elementos más electronegativos. Caso contrario ocurre con los estaos de oxidación -3, el más bajo, que se debe a que los electrones son compartidos con elementos menos electronegativos. Los elementos de este grupo presentan en común el estado +3 donde se comparten los 3 electrones externos dejando un par libre.
El Nitrógeno es un gas incoloro, inodoro e insípido que ocupa un 72.5% de de la superficie de la tierra. Cuando se encuentra en su estado atómico es capaz de reaccionar rápidamente. También es altamente reactivo cuando se eleva la temperatura del sistema y se hace combinar con ciertos metales, hidrógeno u otros elementos.
Por otra parte el Fósforo es un no metal muy inflamable, con algunas alotrópicas en mi post anterior les explique que estas formas son arreglos estructurales distintos que confieren ciertas características a los elementos, en el fósforo se presenta el blanco, rojo, violeta y negro. Este elemento se consigue como un sólido sin forma en forma de fosfatos que son terriblemente tóxicos.

Fosforo
Por último se encuentran el Arsénico es un metaloide, el Antimonio es un semi-metal y el bismuto es un metal pesado, estos tres elementos poseen la característica de ser muy tóxicos para las personas y animales. Por lo que se requiere de una cautelosa manera de trabajarlos.
Existen varios métodos de laboratorio que se pueden emplear para estudiar las características de los elementos que conforman este grupo. En este post les muestro algunos de ellos con el objetivo de nutrirlos en el campo.

Bismuto Antimonio Arsénico
Metodología Experimental y Resultados Obtenidos.
1. Obtención de Nitrógeno (N2) por el desplazamiento de agua.
Procedimiento
Para la obtención de nitrógeno molecular, N2 se procedió a agregar en un matraz provisto de un tubo lateral, 10 mL de soluciones saturadas de cloruro de amonio (NH4Cl) y de nitrito de sodio (NaNO2). Se calentó hasta obtener una corriente de gas. Posteriormente se ensayo su presencia con un fósforo encendido.
Se observó el desplazamiento del agua en el cilindro, indicando la presencia de un gas. Luego al someter a la llama de un fósforo encendido se visualizó la formación del gas con una coloración naranja. La reacción que se pudo haber producido fue la siguiente [1]:

Según lo que indica la reacción anterior el gas observado es consistente con la reacción de desprendimiento de N2. Esta reacción tiene un importe negativo de ∆G que establece que bajo los medios experimentales la reacción es espontánea, exotérmica y se favorece la formación de los productos.
El nitrógeno molecular (N2) también se puede preparar por calentamiento de una solución de nitrito de amonio y sigue la reacción siguiente [2]:


Equipo para la producción de Nitrógeno (N2)-Fuente: @VianniS
2. Obtención de Fósforo Blanco.
Procedimiento
Se agregó en un tubo de ensayo seco unos granos de fósforo rojo, tapándolo con trozos de algodón. Luego se calentó suavemente con una llama débil de manera que el fósforo pasó gradualmente a su alótropo blanco.
Se calentó el fósforo rojo hasta que se produjo un vapor blanco; después de un periodo de tiempo largo, se observó que este se cambió a color amarillo y se observó que ocurría una descomposición como se muestra en la figura siguiente.

El fósforo rojo es una forma alotrópica del fósforo, cuya reactividad es intermedia entre las otras dos formas alotrópicas de este elemento (fósforo blanco y fósforo negro). A diferencia del fósforo blanco (del que proviene principalmente) esta forma alotrópica, no es tóxica. Es así como al calentar el fósforo rojo, siguiendo el procedimiento expuesto anteriormente, se observó el desprendimiento de un humo blanco.
El fósforo blanco consta de moléculas tetraédricas discretas P4, La estructura del fósforo rojo no está bien definida, pero se asume que esta se trata de un polímero formado por cadena de tetraedros. A temperatura ambiente, la modificación estable es la roja, pues por su estructura de elevada polimerización es menos volátil, menos activa y menos soluble que la blanca

Transformación del Fósforo- Fuente: @VianniS
3. Obtención de Amoniaco (NH3).
*Procedimiento
Se mezclaron de 2 g de cloruro de amonio (NH4Cl) e hidróxido de calcio (Ca(OH)2). Se agregó la mezcla en un tubo de ensayo grande provisto de un tubo lateral y calentó bajo la campana. Luego se reconocieron los vapores usando una varilla de vidrio humedecida con HCl concentrado.
Cuando se mezcló el hidróxido de calcio (Ca(OH)2) con cloruro de amonio (NH4Cl) no se observó efervescencia ni cambio de color, esta solución se calentó y se expuso un trozo de papel tornasol a los vapores que emitía la solución, observando el color azul que tomó el papel evidenciando la basicidad del gas, el cual concuerda con la basicidad y la formación del ion amonio como cloruro de amonio mediante la protonación del amoniaco con ácido clorhídrico (HCl). Aquí se produce una descomposición de sus sales calentándolas junto con álcalis, la siguiente reacción confirma lo antes mencionado [4]:


Obtención de Amoniaco (NH3)-Fuente:@VianniS
4. Acción de sales de Zinc (Zn) y Níquel (Ni) con Hidróxido de Sodio (NaOH).
Procedimiento
En tubos de ensayo se trataron sales de zinc y de níquel con hidróxido de sodio, una vez formado los precipitados, se les añadió amonio concentrado (NH3).
Al mezclar la sal cloruro de níquel (NiCl2) con hidróxido de sodio (NaOH) se observó la formación de un precipitado verde [5] que luego al agregarle amoniaco (NH3) cambio a azul y la solución se tornó turbia [6].

En el caso del nitrato de zinc (Zn(NO3)2) con (NaOH) se observó la formación de un precipitado blanco [7] y al agregarle (NH3) se observó la solubilidad del precipitado y la solución se tornó incolora [8].
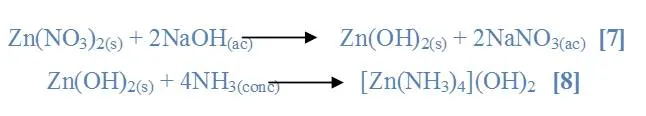
Al mezclar la sal ZnCO3 con (NaOH) se observó la formación de un ligero precipitado color blanco grisáceo [9] y al agregarle (NH3) se observó la solubilidad del precipitado y la solución se tornó de color gris [10].
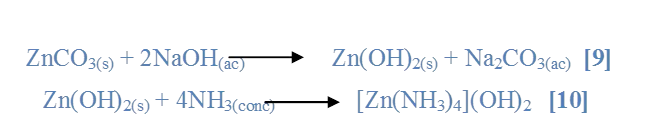
Al mezclar la sal Ni(NO3)2 con (NaOH) se observó la formación de un precipitado color verde [11] y al agregarle (NH3) se observó la formación de tres capas (una verde en el fondo del tubo, una azul en la superficie y una del sólido no disuelto) [12]..

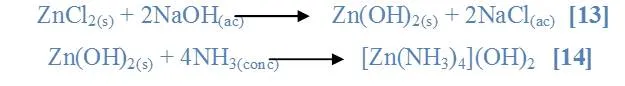
Al mezclar la sal ZnCl2 con (NaOH) se observó que el sólido no se solubilizó [13] y al mezclar con (NH3) se observó una reacción exotérmica y la disolución parcial del sólido [14]

Acción de sal de Níquel (Ni) -Fuente: @VianniS
Por otra parte, un ion complejo; corresponde un compuesto en el que un átomo metálico está rodeado por un conjunto de otros átomos, moléculas o iones denominados ligandos.
Hay que mencionar que el color de los cristales y las soluciones de sal depende de los iones que forman la sal. Las sales son incoloras cuando sus iones (aniones) sí son incoloros, es el caso, por ejemplo, sulfatos y nitratos de sodio, potasio, calcio, amonio, aluminio, zinc entre otros.

Acción de sal de Zinc (Zn)-Fuente: @VianniS
5. Formación del Ácido Fosfórico (H3PO4).
Procedimiento
Se pesaron 0,2 g de fósforo rojo y se colocaron en una capsula de porcelana a la que se le añadió en porciones 2 mL de 10 a 12 mL de ácido nítrico concentrado, Disuelto todo el fósforo y cesado el desprendimiento de gas, se vació el contenido de la capsula en un matraz aforado y se le agrego agua fría.
Al agregar ácido nítrico en una porción de fósforo rojo, con posterior calentamiento, se observó la formación un gas color marrón-amarillento. Según la literatura, cuando se agrega ácido nítrico a fósforo rojo, este se oxida para formar ácido fosfórico, dióxido de nitrógeno y agua según la reacción [15]:

Tomando en cuenta lo anterior, y evidenciándose la formación del dióxido de nitrógeno, por el gas marrón-amarillento observado, se puede decir que esta fue la reacción que se llevó a cabo, la cual es espontanea en condiciones normales de temperatura y presión.
6. Reducción de Nitratos.
Procedimiento
Se añadió 3 ml de solución de KOH al 30% contenido en un tubo de ensayo más 1 ml de una solución de KNO3. Luego se agregó con una espátula una pequeña una porción de aluminio metálico y zinc por último se calentó la solución.
Al agregar el aluminio a la mezcla de nitrato e hidróxido de potasio, y calentarse luego, se observó como en la superficie del aluminio se formaba una capa sólida de color blanquecino, y también la producción de un gas incoloro. De acuerdo a la reacción [16], se produce aluminato de potasio, amoniaco y agua, asumiendo de esta manera que el gas incoloro liberado es amoniaco, y que el sólido blanco producido es aluminato de potasio.
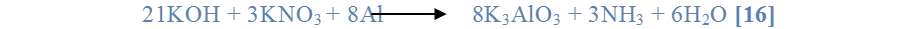
Al ser agregado el zinc a la solución y a medida que transcurría el tiempo el zinc se depositaba en el fondo del tubo, aclarándose así la solución formada al añadir la solución de KOH y KNO3 se produjo un burbujeo y se observó el desprendimiento de un gas. El Zinc quedo en la parte de abajo y la solución quedo transparente; además las paredes del tubo quedaron empañadas, húmedas por el gas desprendido. El Zinc que estaba debajo se disolvió y al ser expuesto a la llama reaccionó completamente y se observó un burbujeo y la expulsión de un gas [17].
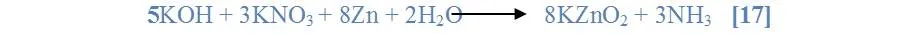
7. Comparación de reacciones en solución.
Procedimiento
Se mezcló en un tubo de ensayo una solución de KNO2 a 1M y una solución de K2Cr2O7 a 1M en medio de H2SO4. Luego se comparo en otro tubo de ensayo la reacción de una solución de KNO2 1M y una solución de KI 1M en medio ácido. Estas dos disoluciones se calentaron suavemente bajo la campana.
La solución era de color naranja (KNO2), al agregarle la solución de KI aparecieron aleaciones producto de la disolución en curso de la mezcla, al reaccionar con el H2SO4 se formó una fase oscura en la parte superior en mayor proporción de color marrón formando una espuma de color mostaza y se observó el desprendimiento de un gas; en la parte de abajo quedo una solución transparente. La reacción que se presume que ocurrió fue [18]:
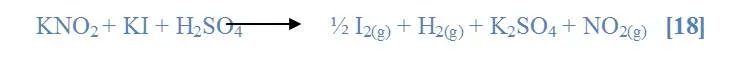

Solución de KNO2 con KI en medio ácido- Fuente: @VianniS
8. Descomposición de las sales de Nitrato.
Procedimiento
Bajo la campana usando tubos de ensayo, se calentó fuertemente hasta descomponer térmicamente las siguientes sales: KNO3 y Pb(NO3)2, identificando el gas desprendido.
Cuando se calentó el nitrato de potasio, se pudo observar la formación de un gas incoloro. Según la bibliografía, el nitrato de potasio en particular se descompone formando oxígeno y nitritos por la reducción del ion nitrato, según la reacción [19]:

De igual manera, se calentó una porción de nitrato de plomo, observándose la formación de un gas marrón, según las bibliografía, debería ser dióxido de nitrógeno, el cual es uno de los productos generados en esta reacción, no se logró observar cambio de coloración en el sólido agregado, pero se asume que el nitrato de plomo, se transformó en oxido de plomo [20].

Disposiciones finales
• A medida que se va descendiendo en el grupo su carácter metálico es cada vez mayor.
• El fósforo y el nitrógeno forman compuestos esencialmente covalentes, mientras que el arsénico, antimonio y bismuto muestran una creciente tendencia hacia el comportamiento catiónico.
• En el laboratorio, el amoníaco se obtiene por la descomposición de sus sales, calentándolas junto con álcalis.
• La obtención del nitrógeno libre se da a través de reacciones con sales de amonio.
• Los elementos del grupo 15, reaccionan mayormente en medio alcalino.
• El carácter ácido va aumentando a medida que son añadidos hidrógenos al ión fosfato
PO4-3 < HPO4-2< H2PO4- < H3PO4 y sus constantes pKa aumentan al disminuir la acidez de las formas de las acuosas de fosfato.
Si te gusto este post y quieres seguir leyendo articulo de calidad te invito a nuestra etiqueta científica de habla hispana #Stem-espanol y si quieres pertenecer a nuestra comunidad puedes entrar al canal de Discord e interactuar con personas con muuuucho conocimiento científico por compartir.
Referencias Bibliográficas.
- William Norton Jones. Inorganic chemistry. Pag. 469
- Sienko, M.,Plane,R., Química. Séptima Edición. Editorial Aguilar. España. 1970. pags 510,511, 523.
- Química Inorgánica. A. G. Sharpe. Editorial Reverte. S.A 1993.
- Rayner-Canham, G., Química Inorgánica Descriptiva. Segunda Edición. Editorial Pearson. México 2000.
- H. Stephen Stoker. General, Organic, and Biological Chemistry. Pag. 225
- Cotton, A., Wilkinson G., Química Inorgánica Avanzada. Primera Edición. Editorial Limusa.1986.
