Saludos estimados amigos, lectores, integrantes y científicos de la comunidad de #Stem-espanol, #SteemStem y #Steemit. En esta ocasión les traigo un poquito más de mi mundo, Químico. Y como sabemos que la química esta en todos los ámbitos de nuestra vida no podemos pasar desapercibidos los alimentos. En cada industria alimenticia existen unos estándares que se deben cumplir antes de llevar al mercado sus productos. En este caso analice la tan consumida Salsa roja, es decir, la salsa de tomate para determinar el contenido de cloruros presentes (Sales). Espero les gusto , Go Ahead!!!
Introducción.
En las valoraciones de precipitación se determina la cantidad de precipitante que es estequiométricamente equivalente a la sustancia que se precipita para determinar, a través de la estequiometría de la reacción. Existen muchos métodos de valoraciones para determinar iones en sustancias solubles. Un método para la determinar los iones halogenuros es el método de Mohr. Este método consiste en la precipitación de iones Cl- o Br- en forma de halogenuro de plata, por titulación con una solución estándar o patrón de nitrato de plata (AgNO3) en presencia del ión cromato (CrO4-2) a baja concentración, como ión que determina el punto final con la aparición de un precipitado de color rojizo, que indica la precipitación completa del haluro de plata. 1
El analista que desee emplear el método ha de tener en cuenta los siguientes aspectos:
La valoración debe llevarse a cabo a un pH comprendido entre 7 y 10, debido a que el ion cromato (CrO4-2) es la base conjugada del ácido crómico débil, y en medio ácido el ion cromato se protona disminuyendo la concentración y formando dicromato (Cr2O7>-). Además el ion plata tiende a precipitar como su hidróxido u óxido a un pH mayor a 10. Adicionando bicarbonato de sodio o bórax a la solución a valorar se logra mantener la concentración de iones hidronio dentro de los límites de pH.
La baja concentración a la que se utiliza el indicador obliga a añadir un exceso de ion plata para empezar la formación del precipitado rojo, y para mantener el precipitado coloreado. Estos dos factores generan un error sistemático positivo en el método de Mohr. Este error puede ser corregido mediante la valoración en blanco de una suspensión de carbonato de calcio, exento de cloruro. 2
Planteados estos aspectos generales se puede determinar la cantidad de cloruro presente en una salsa de tomate y en una muestra problema, utilizando AgNO3 como agente precipitante y una solución de cromato potásico como indicador.

Titulación de la muestra problema- Elaboración propia.
Metodología Experimental
Como parte inicial se procedió con la preparación de una solución de hidróxido de sodio NaOH 0.1M pesando 0,392 g de NaOH puro al 98% y diluyendo en 100 mL de agua hasta el aforo. Esta solución fue necesaria para la regular el pH. También se preparó pesando 0,0966 g del sólido y diluyendo en 50 mL de agua destilada hasta el aforo, una solución de cromato de plata K2CrO4 0,01M la cual serviría como indicador. Ambas soluciones fueron necesarias en la titulación de la salsa de tomate.

Imagen referencial
Para el tratamiento de las muestras de salsa de tomate, el proceso requirió un tiempo de una hora y media: se pesó una muestra de 5,0621 g de la salsa Heinz, se agregaron 50 mL de agua destilada al vaso precipitado y se dejó la solución en reposo por una hora. Mientras esta muestra se encontraba en reposo, se procedió a pesar 3 porciones de 0,1 g de la muestra desconocida (nº 2) las cuales fueron disueltas en 25 mL de agua destilada. A cada una se le adiciono una pequeña cantidad de NaHCO3 para regular el pH y 5 gotas de la solución de K2CrO4 0,25 M.
Seguidamente fueron tituladas con la solución estándar de nitrato de plata AgNO3 hasta la aparición de un color tenue naranja-rojizo. Se determinó la concentración de cloruro (%p/p) en la muestra problema.

Sistema de titulación- Fuente: Elaboración propia.
Luego de pasado el tiempo acordado, se montó un equipo de filtración al vacío para acelerar el proceso y la solución fue filtrada. Al líquido filtrado se le añadió 3 gotas de fenolftaleína y se le añadió la solución de NaOH 0,1M hasta la aparición de un color fucsia debido al indicador fenolftaleína. Listo el tratamiento de la muestra, se extrajeron 3 alícuotas de 5 mL del líquido muestra y fueron tituladas con la solución estándar de AgNO3 , añadiendo 3 gotas de solución de cromato potásico 0,01 M, 10 mL de agua y 4 gotas de la solución NaOH. También fue necesaria la determinación de un blanco. El procedimiento consistió en titular con la solución de AgNO3 50 mL de agua, con una pequeña cantidad de bicarbonato de sodio y 5 gotas de solución indicadora de cromato potásico 0,25 M.
Fuente: Elaboración propia.
Resultados Obtenidos
El volumen obtenido para el blanco tiene una gran importancia ya que cambia totalmente los cálculos posteriores, la presencia de cloruros en el agua destilada utilizada en la determinación pudo haber provisto de errores al momento de determinar la concentración de cloruros. Los volúmenes de la titulación de la muestra problema presentan esta corrección.
La siguiente tabla muestra los volúmenes obtenidos durante la titulación directa para determinar la concentración de cloruros, mediante el método de Mohr. El ion Cl- precipita en forma de halogenuro de plata (AgCl) en presencia de cromato el cual torna la solución de un color amarillo. El punto final se señala por la aparición perceptible y permanente de un precipitado de Ag2CrO4 de color rojizo. Además de un color de solución anaranjado producto de mezcla de colores amarillo del ion cromato libre, y rojo del Ag2CrO4. La estequiometría de la reacción entre Ag+ y Cl- es 1:1, se tiene entonces que: moles AgNO3 = moles Cl-. Esto planteado es igualmente aplicable para la muestra de salsa de tomate Heinz.

Yo. :D
Para saber la precisión de la valoración directa, se calculó la media, desviación estándar y coeficiente de variación correspondiente al volumen de AgNO3 consumido y la masa de la muestra pesada. Por la similitud en los volúmenes gastados y en las masas de muestra pesadas para las alícuotas 2 y 3 fue necesario el cálculo de un test Q para corroborar si se descarta o se conserva el dato dudoso correspondiente a la alícuota 1. Con un límite de confianza de 99% (para n=3, a 99% la QTAB= 0,994). QEXP es igual a 1. Lo que hace que, QEXP > QTAB y se rechaza el dato dudoso. Tras aplicar el test Q, los volúmenes de nitrato gastados y las masas de muestra pesadas están relacionados únicamente a los resultados de la titulación en las alícuotas 2 y 3. Al ser estos datos de igual magnitud, la media se convierte en el mismo valor: 17,6mL y 0,1006 g, la desviación estándar y el coeficiente de variación son entonces iguales a 0 para ambos.
Teniendo en cuenta lo expuesto, se procedió con el cálculo de los gramos de cloruro. Dividiendo estos gramos obtenidos entre la masa de muestra pesada y multiplicando por 100, se obtiene el %p/p.
El porcentaje de Cl- en la muestra problema arrojó un 61.92%. Haciendo uso del siguiente cuadro se observan y se evalúan las diferencias en el porcentaje de cloruros que contienen las posibles sales (teórico) y el porcentaje de cloruro determinado experimentalmente.
| |
|
| |
|
| |
|
El porcentaje teórico de cloruro más cercano al experimental es el cloruro de sodio, con un 60.66 %. Es importante el cálculo de la exactitud con la que se determinó, mediante el uso del error absoluto y el error relativo entre ambos porcentajes: Error absoluto 1,26 y Error relativo 2,07%
El bajo error relativo demuestra una excelente exactitud en el método de Mohr aplicado para determinar la cantidad de cloruro presente en una muestra desconocida y de esta manera identificar la sal de cloruro a través de la comparación de porcentajes teóricos y experimentales de cloruro.
| |
|
Las 3 alícuotas fueron de 5 mL extraídas de una solución de 50 mL
En esta parte de la titulación de la salsa de tomate a pesar de haber agregado 12 mL de la solución de NaOH para regular el pH, las primeras muestras preparadas, que solo contenían esta cantidad, no permitieron en ningún momento observar el vire de color, por lo que fue necesario preparar 3 muestras adicionales y agregarles unas 4 gotas de NaOH y así de manera observar mejor el punto final de la titulación. Los volúmenes plasmados en la tabla anterior corresponden a las muestras adicionales.
Expuesto esto, como se conocen los gramos de cloruro de sodio los cuales se relacionan con los 5,0621 gramos de salsa de tomate de donde se extrajo la muestra tratada, se calcula el porcentaje de cloruro en la salsa de tomate, pero expresado como cloruro de sodio fue de 1,8%
Como ayuda a este procedimiento se utilizó la norma venezolana Covenin Nº 75:1995, que tiene por nombre “salsa de tomate (3era revisión)”. Esta norma estipula que el límite máximo de cloruros en las salsas de tomate para las clases A y B es de 4% p/p, expresado como cloruro de sodio (NaCl). Seguidamente se muestra el cuadro de requisitos fisicoquímicos que debe poseer la salsa de tomate según esta normativa:
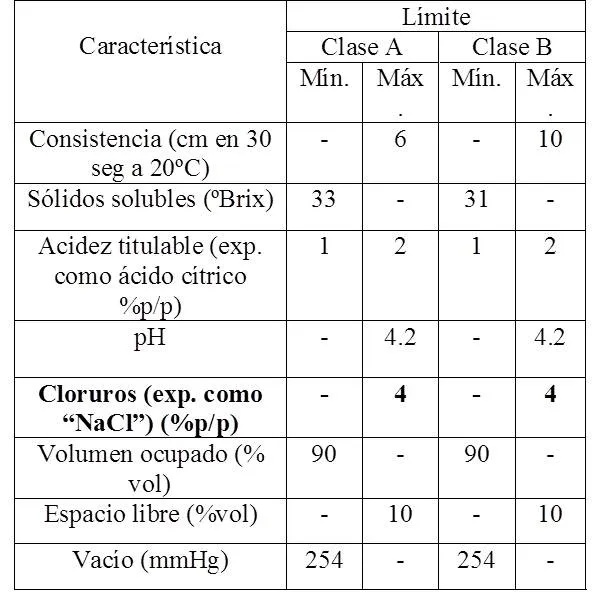
Extraído de Norma Covenin Nº 75:1995, tabla #1, página 4.
La salsa de tomate Heinz, cumple con el requisito establecido en la normativa de Covenin sobre la cantidad de cloruros presentes, con un porcentaje de 1,8%, el cual es menor que el límite establecido de 4%.
Disposiciones finales
Se determinó la concentración de cloruros presentes en la salsa de tomate Heinz y en una muestra desconocida (nº 2) mediante el método de Mohr. Para ello se utilizó una solución AgNO3, la cual se encontraba previamente preparada y estandarizada con una concentración molar promedio de 0.0997 M. Una muestra de salsa de tomate, marca Heinz, fue solubilizada con agua y filtrada para obtener el líquido problema. Tres alícuotas de 5 mL de ese líquido fueron tituladas con solución estándar de AgNO3, 10 mL de agua, 4 gotas de NaOH para regular pH y 3 gotas de solución indicadora de K2CrO4 a 0.01M. En el caso de la muestra desconocida, 3 porciones de la muestra de sales de cloruro (XCl) desconocida, fueron tituladas también con solución estándar de AgNO3, una pizca de NaHCO3 para regular pH y solución indicadora de K2CrO4 a 0,25M. Los puntos finales para ambos casos fueron indicados por un color de solución naranja-rojizo. El resultado de la concentración de cloruro en la salsa, expresada cómo %p/p de NaCl, fue de 1,8% y para la muestra desconocida expresado cómo %p/p de Cl- fue de 61,92%. Según lo descrito en la norma Covenin Nº 75:1995, se determinó que la salsa Heinz cumple con el parámetro fisicoquímico establecido sobre la concentración de cloruros en salsas de tomate. Para la muestra problema, tras una comparación con porcentajes de cloruro presentes en diversas sales teóricas, se concluye que la sal es cloruro de sodio, NaCl
En este vídeo de mi autoria les muestro el viraje de color ocurrido en la titulación.
Bibliografía.
1 Ayres, G. (1970). Capítulo 25: volumetrías de precipitación y de formación de complejos o ionogenos débiles, en “Análisis Químico Cuantitativo”. Editorial Harla. Págs. 354-356
2 Comisión Venezolana de Normas Industriales (COVENIN) Nº 75:1995. “Salsa de tomate (3era revisión)”. Requisitos. Publicado por FONDONORMA. 1995. Caracas, Venezuela.