Hola a todos steemeans lectores. Con ánimos de continuar ilustrado la evolución que tuvo la física clásica hasta convertirse en la actual mecánica cuántica les traigo este post que es continuación como lo prometí del post DE LA MECÁNICA CLÁSICA A LA MECÁNICA CUÁNTICA. Para continuar entendiendo estos principios no existe mejor experimento que el de difracción de partículas por una doble rendija.
Difracción
Difracción de partículas por doble rendija.
El fenómeno de difracción establece un cambio de dirección de la onda al tropezar con una superficie. Este proceso sucede en todas las ondas como las sónicas, las de un fluido y las de luz. En la figura 2 se muestra como ocurre la difracción de una onda de luz pasada por una rendija pequeña sobre un panel oscuro.
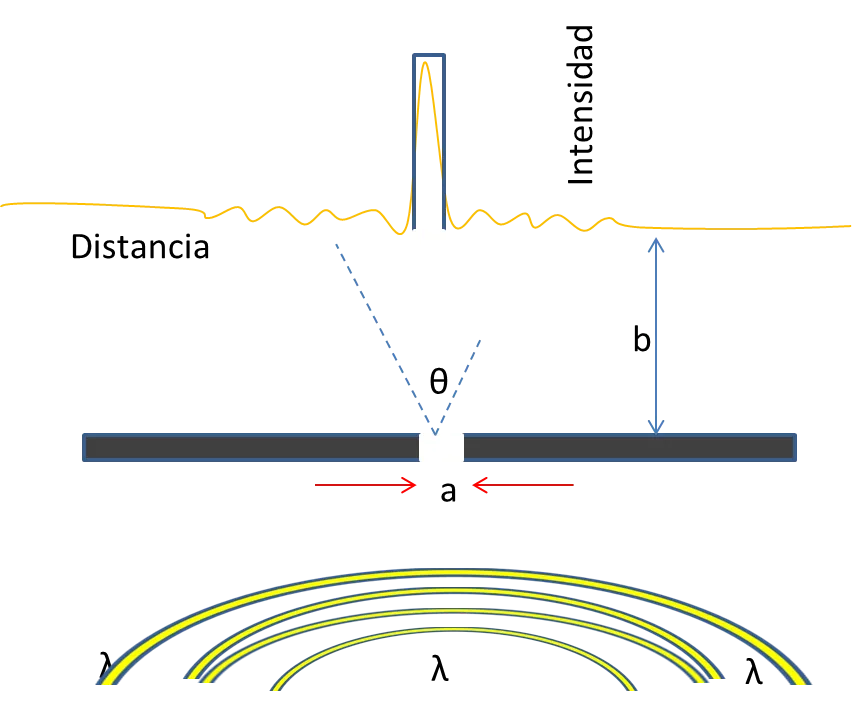
Figura 2. Difracción una rendija -Fuente: Elaboración propia
Estudiar este experimento resulta más entendible si la pantalla que proyecta la difracción está alejada de la rendija por donde pasa la onda, es decir, que el valor de b sea mucho mayor que a. Esto se conoce en la óptica de rayos como la capacidad de focalización, y solo se reflejaría la rendija en la pantalla. Sin embargo, en esta situación es de creer que la luz incidente es paralela a la rendija, por lo que imagen y las longitudes de la rendija son iguales. En caso de no presentarse la difracción el patrón que se observaría seria el que se muestra con la línea cuadrada azul. En cambio, como la longitud de onda λ se compara con la rendija se muestra un modelo de difracción de intensidad versus distancia (Líneas amarillas). Este modelo de mínimos y máximos es resultado de las interrupciones de las ondas. Estos máximos y mínimos se producen de la diferencia en la dirección desde la fuente del rayo incidente y la pantalla. Algunos ejemplos están ilustrados en la figura 2 junto a la ecuación que rige los mínimos.

Figura 3. Difracción de partículas -Fuente: Elaboración propia
Con esta ecuación se permite observar las circunstancias en las que ocurre la difracción. Para ilustrarlo en un ejemplo, imagina una onda de luz de 600 nm de longitud que intenta pasar por una rendija de 1 milímetro de anchura, aplicando la ecuación se tiene un ángulo de ѵ=0.03° para un mínimo, el cual no se apreciaría con facilidad porque estaría muy cerca del máximo. Entonces, que pasaría si se reduciría la anchura de la rendija digamos a 0,001 milímetro, el ángulo seria de ѵ=3,4° por lo que el mínimo y el máximo se distinguirían uno del otro. Esta misma conducta se muestra en la dualidad onda-partícula, es decir, si la anchura de la rendija es más grande que la longitud de la onda, el fenómeno de la difracción no se verá.
Para observar la difracción de partículas se realizaron experimentos denominados de doble rendijas como esta en la figura 4. Este consistió en una lámina de metal con dos rendijas de igual anchura a. Pero ¿Por qué se decide hacer el experimento con doble rendija? Debido a que la difracción solo se presentará cuando una partícula atraviesa ambas hendiduras. La fuente de radiación puede ser un bombardeo de electrones donde se pueda controlar su energía y perturbar la longitud de onda. Estos electrones no interfieren entre sí en la difracción, y sus patrones son sumatorio para incrementar la señal obtenida de difracción. En otras palabras, mientras más electrones se difractan más intensa es la señal.
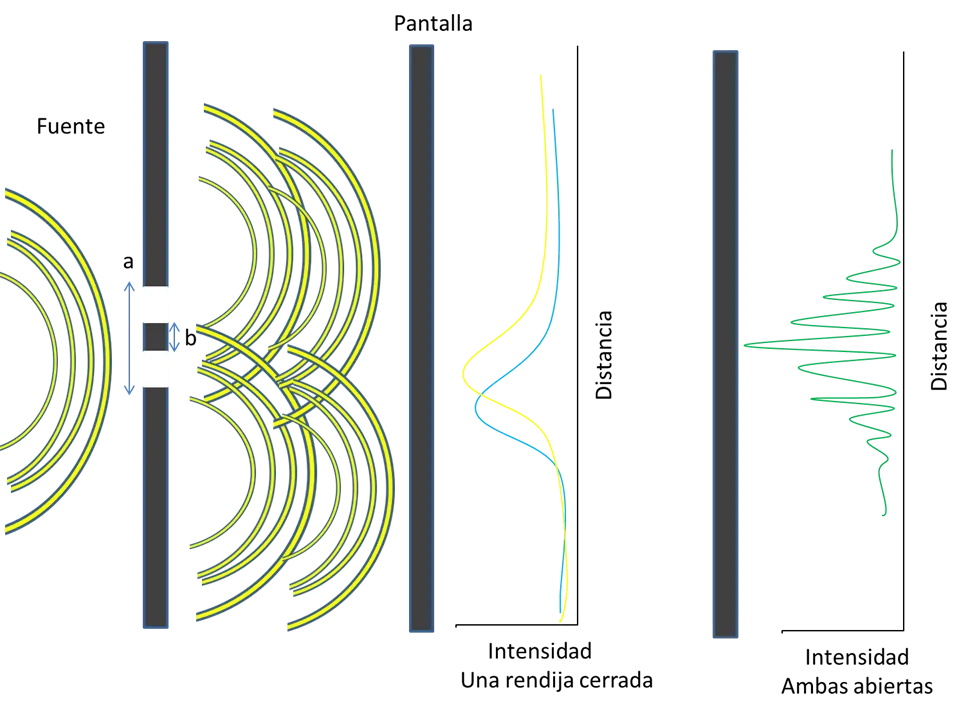
Figura 4. Experimento de doble rendija -Fuente: Elaboración propia
Si una de las dos hendiduras se cierra, el resultado sería similar al mostrado en la figura del centro. De acuerdo a cual hendidura se cierra se verá una u otra curva. En este caso, la partícula tiene comportamiento ondulatorio. Si ambas hendiduras están abiertas la respuesta sería similar a la figura de la derecha. Cuando la cantidad de electrones es pequeña los haces de luz se localizan en una pantalla aleatoriamente, este comportamiento es como partículas. La figura 5 es un ejemplo de como se ve la información si se almacenan las respuestas de cada electrón en una pantalla, es decir, para mostrar la difracción se debe recoger muchas señales individuales. (Una onda incide paralelamente en ambas rendijas, lo que confirma nuevamente la dualidad de una partícula) De izquierda a derecha aumenta la concentración electrónica incidente en las rendijas.
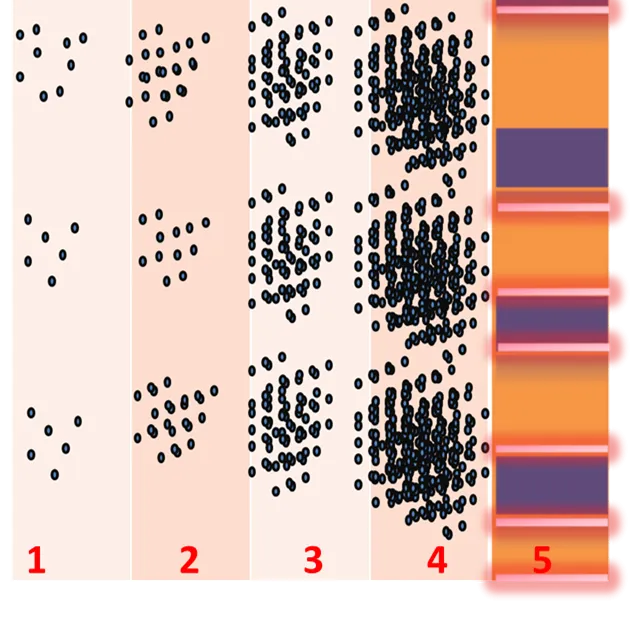
Figura 5. Patrones de difracción -Fuente: Elaboración propia
En palabras más complejas, la función de onda, es una superposición de funciones de onda de electrones que atraviesan una hendidura y la otra, es decir, que una partícula pasa por ambas puertas.
Una aplicación de estos experimentos y la cuantización de la energía son los espectros atómicos descubiertos en 1890.
Espectros atómicos
Los espectros atómicos fueron la demostración de la cuantización de la energía. Estos fueron el resultado de observar que los átomos podían irradiar luz luego de absorberla en plasma como medio. En 1910 Ernest Rutherford experimentando la dispersión de partículas alfas, (Para esto empleó placas muy finas de metales, como el oro, y les bombardeo partículas α, y observó como muchas de estas partículas traspasaban las láminas y que solo unas cuantas mostraba una desviación en la dirección, y un mínimo porcentaje regresaba por el mismo camino hasta la fuente de las partículas. Con esto se desestimó el modelo de Thomson del átomo. Rutherford explico entonces que el átomo debía tener una parte vacía que permitía el paso de las partículas y que en algún punto existía una carga positiva que repulsaba las partículas alfa en otra dirección. Luego propuso el modelo donde los electrones están orbitando alrededor del núcleo atómico.
Por otra parte, el modelo de Rutherford no concuerda con la teoría electrodinámica que establece que los electrones en órbitas deben estar acelerando continuamente y por ende emitiendo energía. La física clásica, diría que debe irradiar energía sin terminar, hasta caer en el núcleo, situación que sabemos que no ocurre. Esto llevo a formular una hipótesis o teoría que hasta la actualidad se afirma y es que los electrones son capaces de absorber energía pasando de un estado de menor energía a uno excitado, el tiempo de vida de este nuevo estado es muy corta por lo que para volver a su estado basal debe liberar la energía absorbida y la hace en forma de fotones.
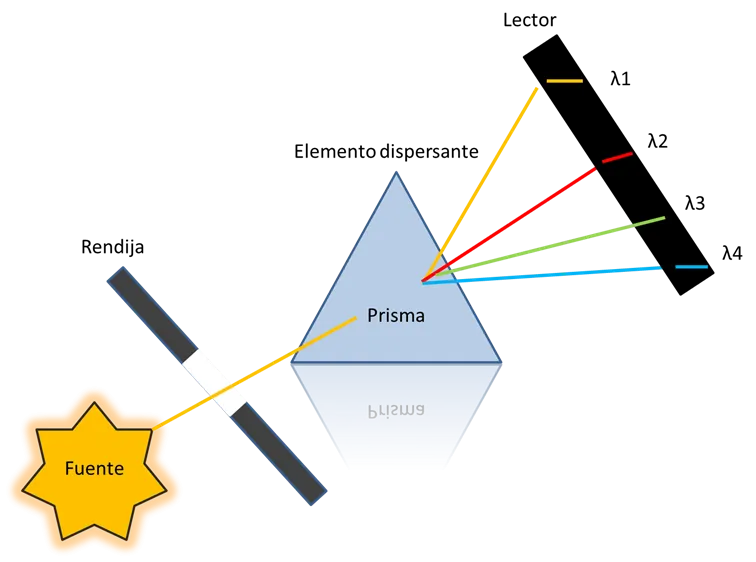
Figura 6.Esquema del primer espectrometro-Fuente: Elaboración propia
En esa época los científicos explicaron estos resultados, definiendo que en el espectro electromagnético solo una porción podía ser observada por el ojo humano, es decir, a algunas longitudes de ondas específicas, cuantización. Obviamente la física clásica no pudo responder a esto, debido a que su teoría establecía que la energía es una variable continua. Para estos primeros experimentos de emisión obtuvieron una ecuación simple que explicó las frecuencias presentes en el espectro. Como se muestra en la ecuación 2.
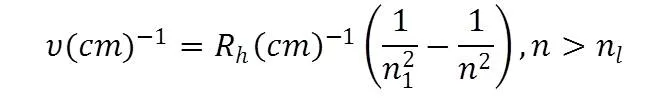
Ec 2
Donde RH es la constante de Rydberg que es utilizada para explicar las señales espectrales de cada elemento.
Este es el limite de lo que se conoce como la física clásica. A partir de estos experimentos y y las nuevas décadas definieron la mecánica cuántica que conocemos hoy en día. El siguiente punto a tratar es la ecuación de Schrôdinger, sin embargo es un tema bastante complejo y extenso que tratare muy pronto.
Saludos mis estimados lectores.
Sigamos cultivando CIENCIAS
Referencias
Ira N Levine, Química Cuántica, editorial Prentice Hall.
Thomas Engel, Philip Ried, Química Física, editorial Pearson.
Raymond Chang, Quimica, Editorial Mc Graw Hill.