
Saludos estimados compañeros de la comunidad, estuve ausente de la plataforma en la última semana por problemas de conexión. Siguiendo en la línea de mis últimas publicaciones, y dejando a un lado la fisiología de los invertebrados, esta vez les traigo un trabajo de investigación sobre las generalidades y las particularidades de la regulación hormonal en los animales superiores (taxonómicamente hablando). En esta oportunidad les hablaré sobre algunos aspectos importantes de la hipófisis y de la adenohipófisis, haciendo énfasis concreto en la relevancia, la función y la estructura de la hormona de crecimiento.
INTRODUCCIÓN:
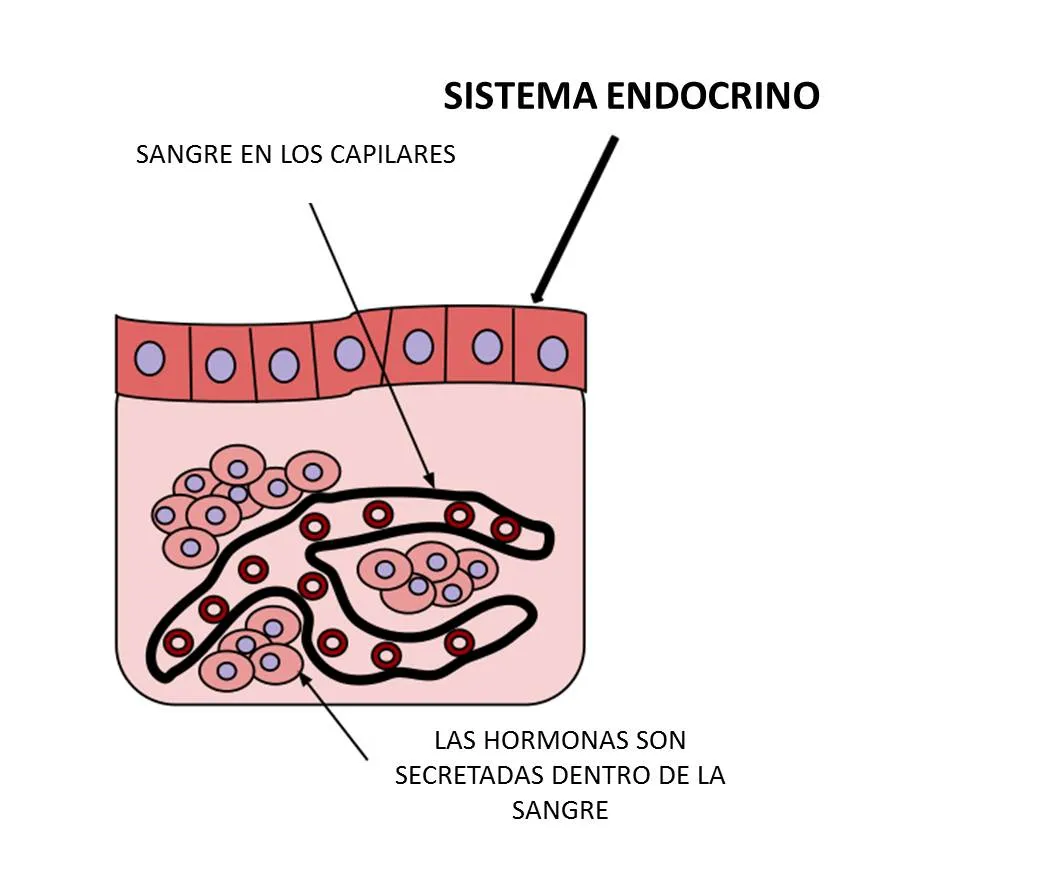
El sistema endocrino de los vertebrados es al igual que el de los invertebrados, diverso y heterogéneo, siendo esto contrario a lo observado con respecto al nervioso. Este último está constituido de una manera jerárquica, basándose en la neurona como la unidad fundamental. En oposición a lo anterior, el sistema endocrino no posee una unidad estructural, encontrándose sus células distribuidas por todo el cuerpo. Esas células pueden formar glándulas bien definidas o estar presentes como tejidos o células individuales, en cuyo caso su secreción es de tipo local. El sistema endocrino se origina embrionariamente a partir de todos los tejidos, incluyendo el nervioso. Del endodermo y el ectodermo se originan glándulas y tejidos productores de péptidos, proteínas y derivados de aminoácidos, en tanto que del mesodermo derivan los que producen esteroides. Excepción a esto último es el caso de los péptidos atriales, producidos en diferentes vertebrados a partir de tejido auricular.
LA HIPÓFISIS Y LA ADENOHIPÓFISIS:
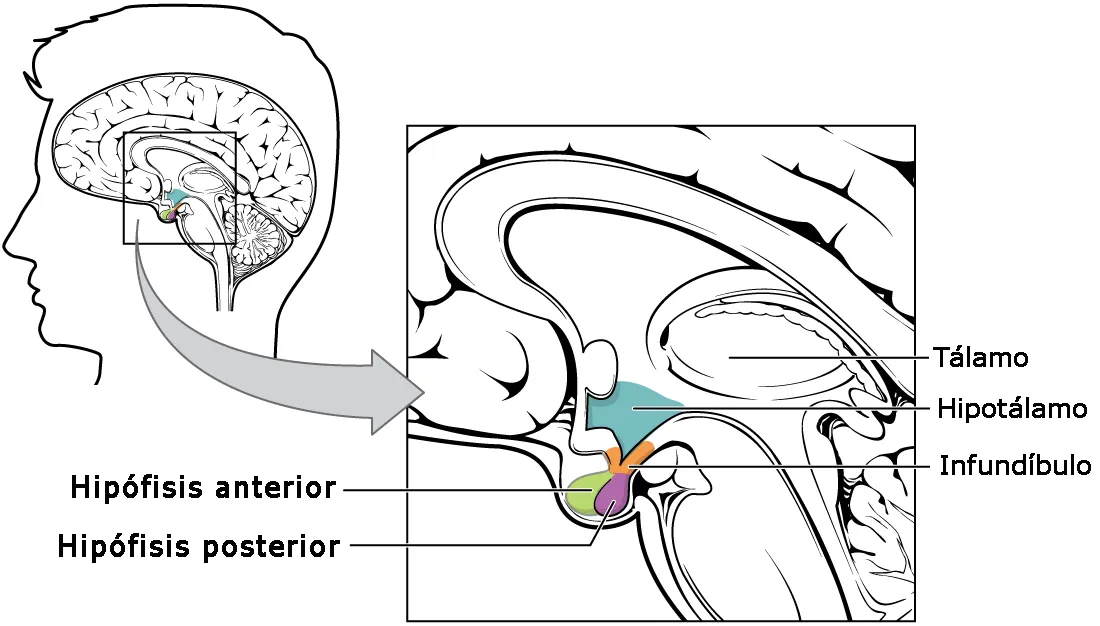
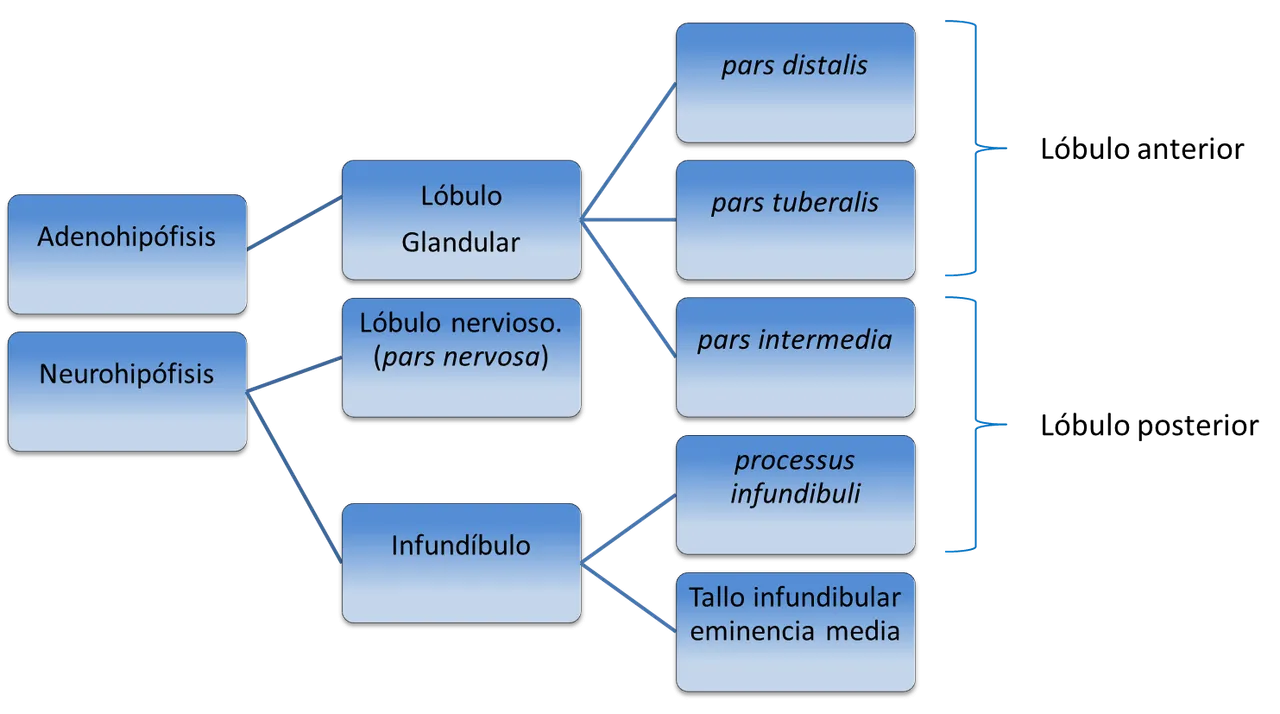
La hipófisis o pituitaria (Fig. 1) es una glándula endoncrina localizada en la silla turca del hueso esfenoides y unida a la base del cráneo por un tallo corto. Su diámetro no llega a 1 cm, en tanto que el peso oscila entre 0,5 y 1 g. La región con la cual limita el tallo hipofisiario es el hipotálamo. La hipófisis consta de dos partes principales, el lóbulo anterior o adenohipófisis y el posterior o neurohipófisis (Esquema 1). A su vez, el lóbulo anterior posee tres partes, como son la distal, la tuberal y la intermedia, no conociéndose ninguna función endocrina definida a la tuberal, aun cuando es la región más vascularizada de la hipófisis y recibe muchas fibras simpáticas. La parte intermedia, por su parte, es muy pequeña en el humano y relativamente avascular aunque en animales inferiores es más grande y de gran importancia funcional.
La adenohipófisis es una región de la hipófisis que presenta los siguientes tipos celulares: somatotrofos, corticotrofos, melanotrofos, lactotrofos, tirotrofos y gonadotropos. Los somatotrofos poseen un citoplasma que se colorea de rosado cuando las secreciones de la adenohipófisis se tiñen con hematoxilia-eosina, por lo cual se clasifican como acidófilas. Este tipo celular no se colorea con el PAS (ácido peryódico de Schiff) o la fucsina básica. Los somatotrofos secretan la hormona de crecimiento (GH) o somatotrópica (STH).
HORMONA DE CRECIMIENTO:

La GH aumenta el apetito, eleva la tasa metabólica, tiene un papel en el mantenimiento de las funciones del sistema inmune e interactúa con otras hormonas, a objeto de regular el metabolismo de los carbohidratos, lípidos, proteínas, ácidos nucleicos y electrolitos. Imagen de dominio público bajo licencia CC0.
La existencia de la hormona de crecimiento (GH, del inglés: growth hormone) fue primeramente demostrada en la segunda década del siglo pasado a través de la habilidad de los extractos de hipófisis para estimular el crecimiento de ratas. En la década del 60 y en la del 70 fue aislada y caracterizada químicamente en varias especies de vertebrados, siendo su actividad funcional sometida a investigación continua. La GH estimula el crecimiento general del cuerpo y su desarrollo, siendo claro que al estimular el crecimiento del esqueleto afecta cada uno de los otros aspectos del funcionamiento corporal. Músculos más largos y fuertes se requieren para mantener la fijación a los huesos y funcionar como efectivas palancas. Debe haber suficiente piel y tejido conectivo subyacente para cubrir toda la estructura corporal. Es imprescindible que la eritropoyesis se acelere, se aceleren el corazón, los órganos respiratorios y la red capilar a fin de proporcionar oxígeno y nutrientes, así como liberar el organismo de desechos metabólicos y calor. Por otra parte, se consume más alimento, alargándose el tracto gastrointestinal, el hígado y los órganos asociados. Concomitantemente, el peso del riñón se adecúa a mayores demandas de excreción. Aun cuando el cerebro no es muy afectado, altos niveles de la hormona influyen su funcionamiento. Es más, las extensiones periféricas del sistema nervioso central deben alargarse para alcanzar sus objetivos. La GH ejerce influencia en membranas plasmásticas, ribosomas, mitocondrias, núcleos y otras estructuras celulares. Blancos de esa hormona son el hueso, el cartílago, la médula de los huesos, el hígado, el riñón, el corazón, el páncreas endocrino, las glándulas mamarias, los ovarios, los testículos, el timo, el tejido adiposo y el hipotálamo. De manera similar a la prolactina (PRL) y la somatomamotropina coriónica (CS), la GH es un polipéptido de cadena sencilla, de 191 aminoácidos, habiendo las tres hormonas emergido de una molécula ancestral común por duplicación genética. La PRL tiene muchas funciones metabólicas que incluyen su intervención en la lactancia y el control del crecimiento mamario.
Aun cuando la GH es liberada a la circulación general y su acción en las células blanco es mediada por su receptor GHR, el conjunto de respuestas inducidas depende del tejido blanco, de la edad de la persona y de la dinámica de la señal; es decir, si es pulsátil o requiere de una presencia continua de la GH. El GHR constituye una glicoproteína que ejecuta una sola vuelta a la membrana y consta de 638 aminoácidos, perteneciendo a la clase I de la familia de los receptores para citoquinas. El GHR no posee actividad quinasa intrínseca, aun cuando el cambio conformacional inducido por la unión al ligando conduce a la activación de las tirosina quinasas asociadas a receptores de la familias de las Janus quinasas (JAK). JAK2 se asocia constitutivamente con el GHR aunque la unión ligando receptor facilita la yuxtaposición y la fosforilación cruzada de las vueltas de activación por quinasas. JAK2 es necesaria para la mayoría de los procesos inducidos por GH. Luego de la fosforilización por la JAK quinasa, varias moléculas de señalización con dominios SH2 son reclutadas por el receptor activado. Las vías de señalización resultantes son células específicas e incluyen la reorganización citoesqueletal, la migración celular, la quimiotaxis, la mitogénesis y/o la prevención de la apoptosis y la transcripción genética. GH activa transductores de señales y activadores de transcripción (STAT), como son el STAT1, STAT3 y dos isoformas de STAT5.
Dependiendo del tipo celular, así como del tiempo y la extensión de la exposición a la GH, la respuesta intracelular puede variar y produce diferentes efectos intracelulares a largo y corto plazo. Adicionalmente, los efectos metabólicos de las exposiciones pulsátil y continua son diferentes, siendo un ejemplo el dimorfismo sexual de las formas de secreción de la GH y las diferencias resultantes en la producción del factor de crecimiento similar a la insulina I (IGF-1), la acción de factores nucleares del hepatocito, así como la formación de hueso. La GH no tiene actividad de crecimiento en ensayos in vitro, considerándose que sus acciones son mediadas por factores de crecimiento como las somatomedinas, de origen probablemente hepático. Al principio se creyó que existían varios de estos factores de naturaleza peptídico que incluían las somatomedinas A, B y C, la somatomedina básica, la actividad no suprimible del tipo insulínico (NSILA) y la actividad multiplicadora. Su purificación y determinación estructural revelaron que las somatomedinas A y C, la somatomedina básica y la NSILA-I constituyen el mismo péptido (factor de crecimiento similar a la insulina, IGF-I), mientras que NSILA-II y MSA son respectivamente los análogos humano y murino del péptido IGF-II. Aun cuando se han descrito recientemente variantes de IGF-I e IGF-II, no hay evidencia firme de la existencia de otras formas de IGF (a pesar de que se ha insistido repetidamente en la existencia de una forma fetal).
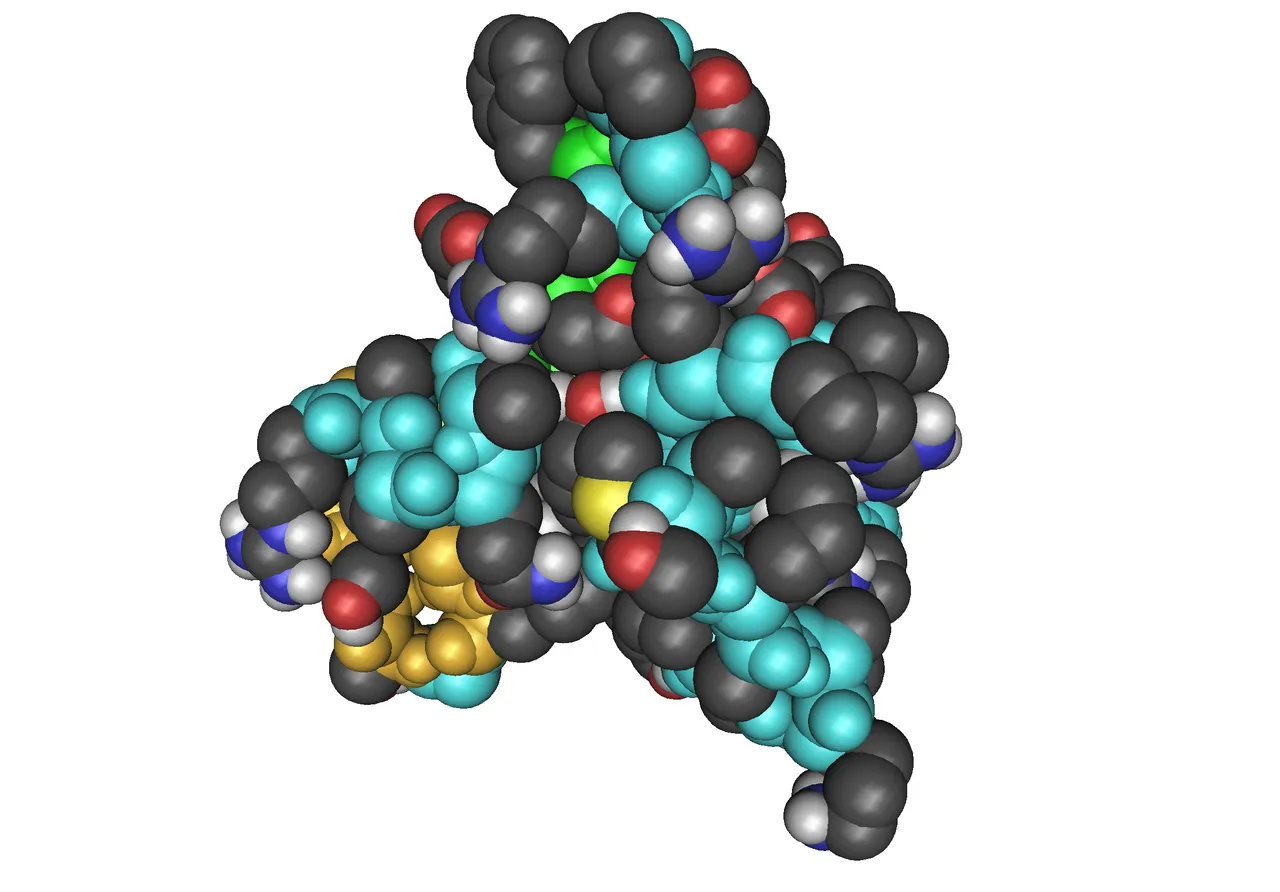

Se conocen las estructuras completas de IGF-I e IGF-II, siendo ambos factores polipeptídicos de cadena simple: IGF-I consta de 70 aminoácidos (peso molecular de 7,65 kDa) mientras que en IGF-II el número es de 67 (peso molecular de 7,47 kDa). Ambos presentan una homología de alrededor del 60%, siendo además homólogos con la insulina (o su precursor proinsulina),con regiones que corresponden a las cadenas A y B de esta última y un péptido conectante que corresponde al péptido C de la proinsulina. La acción de IGF está mediada por el receptor para IGF-I, siendo adicionalmente regulada por las seis proteínas de alta afinidad que unen IGF (IGFBP1 a la IGFBP-6), de las cuales las IGFBP-4 e IGHBP-5 son las más abundantes en el hueso. Generalmente se acepta que el receptor para el IGF-I (IGF-IR), una proteína ligando que atraviesa la membrana y es activada por una tirosina proteínquinasa, media las acciones biológicas de los IGF-I y II, mientras que las IGFBP juegan un papel más modulador, regulando la vida media de IGF y el acceso a IGF-IR. El papel de los IGF difiere del de la insulina por cuanto, a diferencia de esta última, su función principal no involucra fundamentalmente al metabolismo celular. Las vías de señalización de la insulina y de los IGF son notablemente similares, consistiendo las diferencias principales entre esos dos ligandos en su estructura, sus receptores y preferencias con respecto a la unión como ligando. El receptor para la insulina (IR) aparece predominantemente en la superficie de los tejidos muscular, adiposo y hepático, en comparación a IGF-IR que también tiene presencia en otros tejidos. También se presentan híbridos heterodiméricos entre IGF-IR e IR. Estos receptores híbridos tienen una afinidad ligeramente menor por la insulina que los homodímeros completos de IR. Adicionalmente, aun cuando la insulina, IGF-I e IGF-II comparten una arquitectura 3D común, su unión a IR e IGF-IR varía en afinidad. Esta familia de receptores insulínicos comprende además de IR y IGF-IR, el receptor relacionado con el receptor insulínico (IRR). No se ha reportado ligando para este último y su función en condiciones fisiológicas se desconoce.
Una de las características del IGF-I es que está regulado por la GH. La estrecha relación entre la secreción de la GH que es pulsátil en la mayoría de las especies y los niveles circulantes de IGF-I, forma la base del uso del registro de éste como un indicador del status secretor de la GH. Además de lo mencionado anteriormente con relación al efecto del IGF-I en los diferentes tejidos, es de señalar que IGF-I actúa en el sistema nervioso, afectando diversas poblaciones celulares particularmente relacionadas con funciones cerebrales superiores como cognición y homeóstasis durante el envejecimiento. Otros factores que regulan los niveles de IGF-I son la edad y el status nutricional. El IGF-I se presenta a unos niveles bajos en el neonato, aumenta a través de la etapa prepuberal hasta alcanzar valores picos durante la pubertad, disminuyendo lentamente con la edad.
Es muy importante el papel de IGF-I en la función renal, ya que perturbaciones en el eje GH-IGF-I son responsables de complicaciones muy severas en la enfermedad crónica renal, como el crecimiento retardado, disminución de peso caquéctica y la progresión de la enfermedad. Imagen de dominio público bajo licencia CC0.
EJEMPLOS INTERESANTES SOBRE LA EVOLUCIÓN FUNCIONAL DE LA GH EN LOS VERTEBRADOS.

En algunos teleósteos se ha sugerido un papel para la GH en la osmorregulación. En el salmón, por ejemplo, parece favorecer la adaptación al agua de mar, aunque se carece de datos en relación a su modo de acción. En otros teleósteos como Tilapia no se ha podido demostrar un papel de la GH en la retención de sodio. Imagen de dominio público bajo licencia CC0.

Hipófisis trasplantadas de algunos anfibios estimulan un crecimiento más rápido que el usual, lo cual puede ser debido a la secreción de la GH circulante, aunque también podría ser causado por la secreción de la PRL. Aun cuando la GH circulante de la rana toro aumenta durante el climax metamórfico, el antisuero para la GH no previene la metamorfosis, en razón a lo cual es difícil determinar niveles de secreción de la GH en anfibios en base a crecimiento y diferenciación. Imagen de dominio público bajo licencia CC0.

Considerables cambios en las concentraciones plasmáticas e hipofisiarias de la GH tienen lugar durante toda la vida de las aves. Las concentraciones de GH en el pollo, pavo, pato, ganso y paloma son altas en los estadios tempranos del crecimiento neonatal, declinan paralelamente con el avance de la madurez y son bajas en el animal adulto. Durante el crecimiento neonatal, la mayor parte del lóbulo caudal de la parte distal de la hipófisis del pollo está compuesta de somatotrofos, en tanto que en el adulto tales células se encuentran dispersas. Existen evidencias de una participación de la GH en la vitelogénesis inducida por estrógenos, puesto que la GH bovina estimula ese proceso en animales hipofisectomizados. Imagen de dominio público bajo licencia CC0.
Bibliografía consultada:
• Brooks, A.J.; Wei Wooh, J.; Tunny, K.A. & Waters, M.J. (2008) Growth hormone receptor; mechanism of action. Intern. J. Biochem Cell Biol. 40: 1984-1989.
• Foulstone, Prine, S.; Zaccheo, O.; Burns, J.L.; Harper, J.; Jacobs, C.; Church, D. & Hassan, A.B. (2005) Insulin-like growth factor ligands, receptors, and binding proteins in cancer. J. Pathol. 205: 145-153.
• Merz, W.E. (1992) Properties of glycoprotein hormona receptors and post-receptor mechanisms. Exp. Clin. Endocrinol.100: 4-8.
• Pilecka, I.; Whatmore, A.; Hooft van Huijsduijnen, R.; Destenaves, B. & Clayton, P. (2006) Growth hormone signaling : sprouting linksbetween pathways, human genetics and therapeutic options. Trends Endocrinol. Metab. 18: 12-18.
DESCUBRE OTROS ARTÍCULOS INTERESANTES VISITANDO LA ETIQUETA #stem-espanol.

Imagen elaborada por @josearmandor para la comunidad #stem-espanol. La imagen utilizada en el fondo es de dominio público.
