Agua (H2O): el pegamento de la vida
Hola de nuevo a todos, apreciados colegas y amigos de STEEMIT. En el Capítulo 8 de “La Física es Divertida” centramos nuestra discusión en una de las propiedades más cotidianas del aire, tal como el proceso de compresión-descompresión por temperatura. Observamos cómo es posible comprimir un envase plástico sin aplicar fuerza alguna, sólo enfriándolo y después expandirse al calentarse.
Si te perdiste este Capítulo así como los anteriores, puedes revisarlos en los siguientes enlaces:
En mis cursos de Física básica siempre realizo a los estudiantes preguntas sencillas sobre los fenómenos cotidianos y de su entorno. Algunas de esas preguntas son:
La primera pregunta siempre tiene la misma respuesta: líquido sin color, olor ni sabor…Eso demuestra que no conocemos las propiedades básicas del compuesto que nos ha dado la vida, junto al aire. Para responder las otras preguntas debemos observar y experimentar un poco. El objetivo de este trabajo no es solo responder estas preguntas, sino también mostrar que se puede resolver un problema de física sin equipamientos complejos y costosos y sin tener gran experiencia en física.
Con la finalidad de hacer este proyecto más interactivo, les agradezco dejarme sus inquietudes y preguntas en un REPLAY, y así darles respuesta.
Para más información sobre este tema y otros relacionados con Ciencia, Física y Tecnología, les invito visitar mis sitios:
Agua (H2O): líquido vital
Siendo el agua el compuesto más abundante en el planeta y responsable de la vida como la conocemos, deberíamos tener más conciencia sobre sus propiedades más elementales. 70 % del planeta contiene agua y 65 % de nuestro cuerpo está hecho de agua. Esto hace al agua tan familiar y al mismo tiempo desconocida. Solo la consumimos sin entender sus propiedades más elementales.
Los misterios del agua comienzan desde su propia estructura molecular. La molécula de agua es quizás la más popular entre todas las moléculas conocidas, y forma parte de nuestro lenguaje cotidiano: H2O. Dos átomos de hidrógeno unidos a un átomo de oxígeno a través de puentes de hidrógeno (enlaces covalentes), formando un ángulo de 105°. De esta manera se forma una estructura molecular asimétrica y dipolar eléctrica (ver Figura 1) y es el origen de las propiedades del agua. Es el ejemplo más elemental de cómo dos elementos gaseosos pueden formar un compuesto en estado no gaseoso.
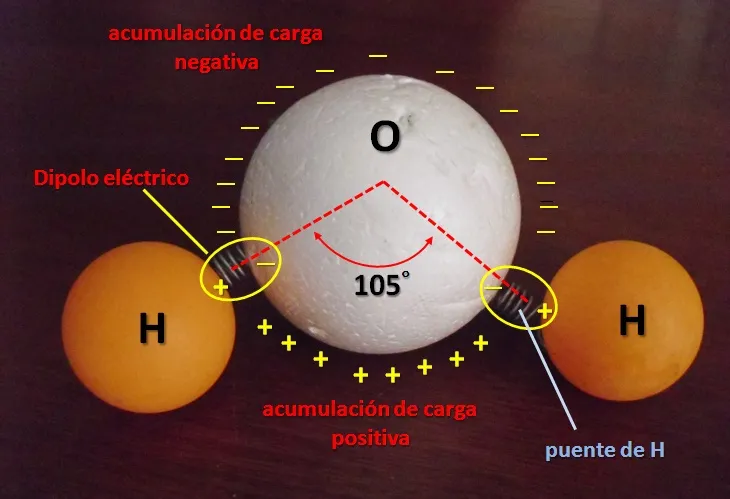
Figura 1. Modelo de molécula de agua. La distribución de cargas origina un dipolo eléctrico asimétrico (Figura original propiedad del Autor).
1. El agua existe en estado sólido (hielo), líquido y gaseoso (vapor de agua). Dependiendo de la temperatura y presión puede cambiar su estado. A temperatura y presión ambiente (303 K, 1 atm) se forma un líquido transparente, homogéneo, sin sabor, sin olor. Cuando calentamos el agua líquido hasta su punto de ebullición (100°C, 373 K) se transforma en un gas homogéneo y blancuzco llamado vapor de agua. El vapor de agua se condensa rápidamente al interaccionar con una superficie más fría, formando gotas de agua líquida.
En general, cuando un líquido se enfría hasta su punto de congelación su densidad aumenta formando un compuesto sólido. En el caso del agua líquida, cuando esta se enfría desde temperatura ambiente hasta 0°C (273 K) se forma agua sólida o hielo. Sin embargo, en 4°C las moléculas de agua comienzan a formar cristales tetraédricos que hacen al hielo menos denso, y debido al Principio de Arquímedes el hielo puede flotar en el agua líquida. Aunque este es un evento extremadamente cotidiano, el agua es el único compuesto natural cuyo estado sólido flota en el estado líquido. Un ejemplo de esto son los témpanos de hielo en los polos terrestres. A parte de esto, al disminuir su densidad desde 4°C hasta 0°C el hielo también aumenta su volumen, y por eso los envases que contienen agua congelada explotan o se expanden. En la Figura 2 se muestra cómo coexisten el hielo y el agua líquida.

Figura 2. Hielo y agua coexistiendo al mismo tiempo y en el mismo espacio. Mostramos sus ordenamientos moleculares en cada fase (Fotografía tomada con un dispositivo celular iPhone 5s/ 8MP/1Gb RAM/7.6 mm).
2. Solvatación. Proceso mediante el cual la materia es disuelta por acción de otro material formando soluciones estables. Al material disuelto se le denomina soluto y al que disuelve se le llama solvente. El agua es el solvente más eficiente de la naturaleza y se le conoce como solvente universal. Ejemplos cotidianos de solvatación por agua son la erosión de las rocas y la disolución de sales y azúcares, así como la disminución del tenor de alcohol en las bebidas espirituosas.
3. Viscosidad. Resistencia que tiene un fluido al movimiento. El agua es un líquido viscoso y esto se debe a las fuerzas intermoleculares. Mayor viscosidad no implica mayor densidad. Como se puede comprobar mezclando agua con aceite. Esta propiedad será tema de un próximo artículo.
4. Cohesión y adhesión. Entre las propiedades más extrañas del agua está su alta cohesividad. Después del mercurio es el compuesto más cohesivo que se conoce en la naturaleza. La cohesión es la capacidad que tienen las moléculas de un material para mantenerse unidas. Debido a que las fuerzas de cohesión son fuerzas de contacto, el agua tiene la propiedad de formar gotas, y estas gotas unirse para formar gotas mayores, sucesivamente hasta volúmenes grandes de agua. Para formar gotas es necesario que las moléculas de H2O se “peguen”. Esto es posible gracias a que los átomos de O se enlazan en serie a través de fuerzas electrostáticas de corto alcance formando los llamados “enlaces colgantes” ó “dangling bonds” en inglés. Si se rompen estos puentes intermoleculares se forman gotas más pequeñas pero idénticas a sus predecesoras, por lo que decimos que las gotas de agua son auto-similares. Decimos que una gota de agua es entonces:

Figura 3. Estructura interna de una gota de agua y origen de las fuerzas de cohesión. La acumulación de gotas en un vaso origina una gota gigante flotando en la superficie (Diseño original del Autor).
Otra propiedad importante del agua que vemos siempre pero no comprendemos es que se pega a casi todo. Esta propiedad la llamamos adhesividad. Y confiere al agua el premio de “Pegamento de la Vida”. Dos objetos mojados se pegan ó se adhieren. Esto es debido a la formación de una capa de agua entre los dos objetos, es decir un sistema interfacial sólido/agua/sólido. A diferencia de la cohesión donde la interface agua/aire se caracteriza por un menisco convexo, durante la adherencia de dos sólidos se forma una lámina de agua con menisco cóncavo. Por otro lado, debido a que la molécula de agua es altamente polarizada, en la interface de contacto agua/sólido se produce un re-arreglo de cargas eléctricas en el sólido, lo que dá lugar a fuerzas electrostáticas. Al igual que la fuerza de cohesión, la fuerza de adhesión es de contacto. En la Figura 4 mostramos el origen físico de las fuerzas de adhesión del agua.
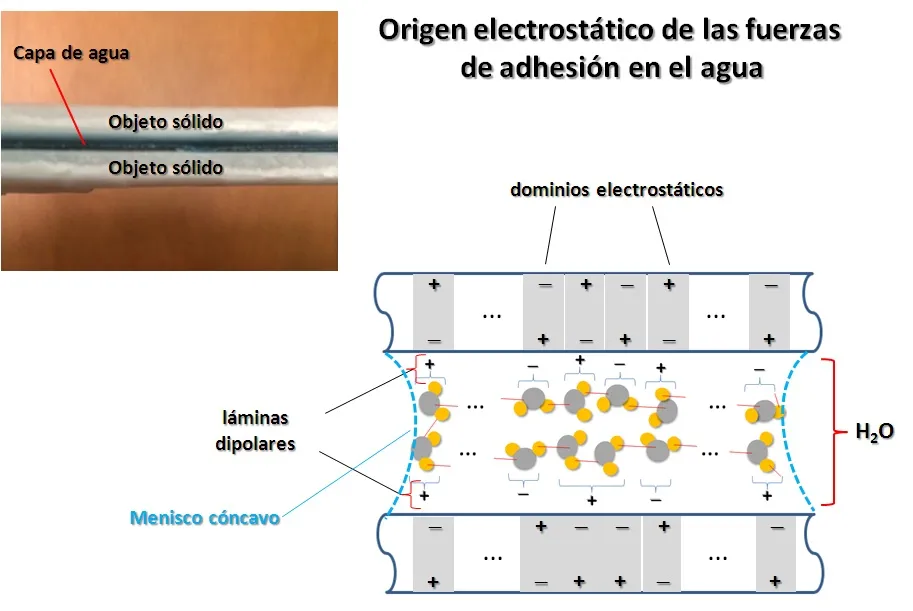
Figura 4. Origen físico de las fuerzas de adhesión entre el agua y un objeto sólido (Figura original del Autor).
Demostración: fuerzas de adhesión
Una vez revisadas las propiedades básicas del agua, quiero concentrarme en las fuerzas de adhesión que hacen del agua el “pegamento universal”. Ya sabemos que en estado líquido el agua se pega a casi todo, sin embargo, surge la pregunta lógica:
Para la demostración que les propongo solo necesitamos cualquier pedazo de material sólido re-utilizable, tal como plástico, anime, metal, vidrio, entre otros. Y evidentemente agua en estado líquido y vapor de agua. Les dejo a continuación con una serie de videos demostrativos al estilo propio de la “Física es Divertida”.
Comentarios finales
El agua es el mayor componente de todas las cosas vivas en el planeta. Estamos rodeados de agua por todas partes, y sin embargo, no comprendemos bien su comportamiento anómalo. Luego de realizar una breve revisión sobre algunas de las propiedades más resaltantes del agua, nos centramos en la que quizás es la más cotidiana: su capacidad de adherirse a casi todo.
Vimos como es posible probar las propiedades del agua sin ningún instrumento sofisticado, solo elementos desechables y nuestra capacidad de observación e imaginación. Les mostré como el agua se pega a casi todo lo que toca, convirtiéndose en el “PEGAMENTO DE LA NATURALEZA” que mantiene la vida en La Tierra. También les mostré que esta propiedad no es exclusiva del estado líquido, sino también en estado gaseoso o de vapor de agua.
Finalmente, quiero llamar la atención de la comunidad de docentes tanto a nivel medio como universitario, para que consideren incorporar en sus actividades docentes la discusión de estos problemas cotidianos, donde las leyes y principios de la física son la base fundamental.

Lecturas sugeridas sobre física divertida y otras curiosidades de física:
1. Neil Ardley, 101 grandes experimentos. La ciencia paso a paso (Ediciones B, 1997).
2. Isabel Amato y Christian Arnould, 80 experimentos para hacer en casa. Respuestas a los curiosos (Ediciones B, Barcelona, 1992).
3. Fundación Thomas Alva Edison, Experimentos fáciles e increíbles (Martínez Roca, Barcelona, 1993).
4. Judith Hann, Guía práctica ilustrada para los amantes de la ciencia (Blume, Barcelona, 1981).
5. Antonella Meiani, El gran libro de los experimentos (San Pablo, Madrid, 2000).
6. Yakov I. Perelman, Física recreativa (Eds. Martínez Roca, Barcelona, 1971).
7. Yakov I. Perelman, Problemas y experimentos recreativos (Mir, Moscú, 1975).
8. Gaston Tissandier, Recreaciones científicas, o la física y la química sin aparatos de laboratorio y sólo por los juegos de la infancia (Alta Fulla, Barcelona, 1981).
9. Tom Tit, La ciencia divertida (José J. de Olañeta, Palma de Mallorca, 1992).
10. Alejandra Vallejo-Nágera, Ciencia mágica. Experimentos asombrosos para genios curiosos (Martínez Roca, Barcelona, 1999).
11. Janice P. Van Cleave, Física para niños y jóvenes. 101 experimentos super divertidos (Limusa, México, 1997).
Lecturas adicionales sobre la molécula de agua y sus propiedades
12. Cracolice, Mark S. and Edward Peters I. Basics of Introductory Chemistry. Thompson, Brooks/Cole Publishing Company. 2006.
13. Petrucci, et al. General Chemistry: Principles & Modern Applications: AIE (Hardcover). Upper Saddle River: Pearson/Prentice Hall, 2007.
14. Kim A Sharp, Water: Structure and Properties, ENCYCLOPEDIA OF LIFE SCIENCES, John Wiley & Sons, 2001.


