Hola a todos

Fuente de la imagen: Propia
Introducción
Las prácticas de laboratorio siempre han sido muy fructíferas en el marco de la enseñanza de las ciencias naturales. De hecho, numerosos reportes a nivel de investigación en educación de media general o bachillerato han documentado las habilidades motrices y cognitivas que pueden desarrollarse durante este tipo de actividades. Ayudan a desarrollar destrezas en el campo de la experimentación que son fundamentales para en el campo de la ciencia. Además, el estudiante contrasta la base teorica o un conocimiento conceptual, con la practica o con un conocimiento procedimental.
En estos escenarios, los estudiantes son sujetos activos durante la dinámica de la clase. Teniendo esta posición, ellos forman parte del mundo de la ciencia, poniendo a prueba su curiosidad por comprender evidencias científicas. Todo esto es respaldado puesto que, este tipo de experiencia ayuda a los estudiantes a entender desde el punto de vista empírico, como se construye ciertos contenidos científicos. Aunando, que en su formación saber el procedimiento o protocolo de un experimento ayuda a su formación académica. La actividad experimental fue realizada conjuntamente con los estudiantes, y fue tratada la practica de precipitaciones o precipitado.

Fuente de la imagen: Propia y editada en power point
Breve explicación teórica
La aparición de un sólido en el interior de una solución acuosa de iones cuando se adiciona un reactivo que forme un producto insoluble con uno de sus iones se denomina precipitaciones y el producto iónico formado se llama precipitado. En otras palabras, se forma un compuesto o solido el cual no es soluble, a esta estructura que se forma es llamado precipitado.
Comúnmente el compuesto es decir el precipitado, llega al fondo de la solución. Sin embargo, todo dependerá de la densidad presentada, llegando completamente al fondo de la solución la densidad del precipitado es mayor con respecto al medio (a la solución), mientras que si esta medianamente arriba como si estuviera flotando, quiere de decir que presenta una baja densidad y por último si queda esparcido por todo el medio, se dice que la densidad del precipitado es parecida al medio (a la solución), es decir tiene un densidad equivalente con respecto a la solución en la cual se está vertiendo.

Fuente de la imagen: Propia y editada en power point
Por otra , parte tenemos la ecuación molecular, se dice que son consideradas moléculas o compuestos neutro o sin carga eléctrica. Y, la ecuación ionica, se menciona que cada ión aparece con su carga eléctrica + ó - dependiendo si han perdido o ganado electrones respectivamente. En la ecuación iónica neta, aparecen los iones + y - responsables de la formación del producto sólido o precipitado.
Ejemplo de ecuación molecular:

Fuente de la imagen: Propia y editada en power point
De ecuación iónica:
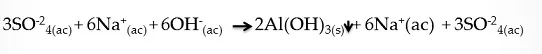
Fuente de la imagen: Propia y editada en power point
De ecuación iónica neta:
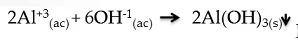
Fuente de la imagen: Propia y editada en power point
Cuando hay precipitaciones, el producto de las concentraciones ionicas excede el valor del producto de solubilidad. Todo estas reacciones de precipitaciones, permite sistematizar las pruebas o ensayos a seguir para lograr separar e identificar cationes solubles e insolubles de muestras de sustancias desconocidas. Además, tienen importancia en el área medica para trabajar con las reacciones de antígenos en un estado soluble con su anticuerpo.
Momento de la práctica
Los siguientes materiales fueron los empleados para la realización de la actividad:
- Disoluciones.
- Tubo de ensayo limpio: En cada uno vierte la muestra con la cual deseas trabajar, preferiblemente 5ml de disolución.
- Gotero: Utilizado para extraer la disolución, aplicando de 5 a 8.
- Cuaderno de registro o de apuntes: Empleado para anotar las observaciones y las reacciones.
El procedimiento en el ensayo de precipitaciones de cationes con reactivos generales fue de la siguiente manera, primero se procedió a colocar las disoluciones con las cuales se desean trabajar. Algunas son; catión cuprico, catión ferroso, catión ferrico y catión plumboso.

Fuente de la imagen: Propia y editada en power point
Luego, de cada una fueron tomadas muestras de aproximadamente 5ml vertidas en los tubos de ensayo, después se aplico con el gotero unas 5 a 8 gotas de disoluciones para observar las reacciones de precipitaciones. Mientras que con el cuaderno de apuntes, primero fue anotado lo observado con las descripciones completas. Así como en el campo de biología, cuando se realiza salidas al campo u observación en el microscopia, los registros son sumamente relevantes, puesto que muchas veces pueden ser nuestro marco de referencia.

Fuente de la imagen: Propia y editada en power point
Por último, podemos observar algunas reacciones con sus ecuaciones:
1.- Catión cúprico y Catión ferroso

Fuente de la imagen: Propia y editada en power point
2.- Catión ferrico y Cation plumboso

Fuente de la imagen: Propia y editada en power point
Nota final
Como es bien sabido, las practicas de laboratorio ayudan a los estudiantes a desenvolverse en los protocoles experimentales, favoreciendo el entendimiento de la enseñanza de las ciencias. Este tipo de actividades así como otras, como la salida al campo, la observación células o la observación de microorganismos, entre muchas más, promueven la curiosidad, la indagación, el aspecto de detective por parte del estudiante, para aprender más sobre la naturaleza y comprender aún más los fenómenos de nuestro mundo y del espacio.
Referencia de la información
- H. Curtis. Biología general
- Trujillo. Soluciones acuosas: teoría y aplicaciones. Módulo de apoyo académico en Química
- Aportes para la enseñanza para el nivel medio. Consultado 2018
- López y col. 2012. Las prácticas de laboratorio en la enseñanza de las ciencias naturales.