Hola a todos

Introducción
Como en otras ocasiones, voy mostrar el procedimiento de una práctica de laboratorio. Este tipo de actividades procedimentales son utilizadas en muchos casos para respaldar lo leído en los textos académicos. Además, desde el punto de vista de la didáctica es considera una promotora de las habilidades de conocimiento, despertar de curiosidades de fenómenos naturales, entre otras cosas. Es de vital importancia, que estas estrategias para materias como biologías y química (también física), no sean olvidadas durante el proceso de enseñanza. En esta oportunidad y para la comunidad #stem-espanol voy a comentar un poco sobre las reacciones redox y algunos procedimientos para realizar las prácticas de laboratorio.

Esbozo teórico
Las reacciones redox conocidas también con el nombre de reacciones de óxido-reducción, es cuando en cualquier reacción los electrones son transferidos entre los distintos reactivos, generando cambios en los estados de oxidación. Antes se utilizaba el término oxidación para referirse a reactivos o sustancias que obtenían o tomaban el oxígeno, mientras que para el reductor o reducción era aquel que soltaba el oxígeno. En la actualidad se aplican otras definiciones para estos casos:
- Oxidación: cambio químico en el cual un átomo, ion o molécula pierde electrones (e-) y su número de oxidación aumenta.
- Reducción: Cambio químico en el cual un átomo, ion o molécula gana electrones (e-) y su número de oxidación disminuye.
Veamos un breve ejemplo:

En este caso el Fe se oxida, su número de oxidación pasa de O a +3 (aumenta) y el O2 se reduce su número de oxidación pasa de O a -2 (disminuye). Entonces una reacción de Oxido-reducción (redox) es un: cambio químico que involucra procesos de oxidación y reducción simultáneos, tal como se observa en el ejemplo anterior. En estos procesos el número de electrones ganados y periodos debe ser igual.
Las reacciones de óxido-reducción llamadas redox, están íntimamente involucradas en nuestra vida diaria y bienestar. Los procesos que permiten hablar, pensar, caminar, metabolizar los alimentos se fundamentan en reacciones redox. La fotosíntesis de las plantas verdes, proceso vital para el planeta, es una reacción redox, al igual que el fenómeno de respiración celular. Los celulares, controles remotos, radios portátiles, linternas, marcapasos, entre otros funcionan con pilas o baterías, en las que se verifican reacciones redox.
Vale decir, que durante estas reacciones como fue bien nombrado tenemos a los agentes reductores y los agentes oxidantes, los primeros son llamados así porque se oxidan y el segundo porque se reduce. El agente reductor, genera una reducción en la otra estructura molecular y el agente oxidante, produce la oxidación de la otra estructura molecular. Algunos ejemplos de estas reacciones son:

Además, podemos apreciar este tipo de reacciones redox como fue dicho en muchos planos. En las células ocurren complejas reacciones en la cual participan trasferencias de cargas eléctricas, de igual manera del intercambio de iones y electrones. En el metabolismo, podemos ver reacciones en las cuales participan catalizadores para que el proceso biológico siga con su ruta. En el caso del flujo de electrones, de manera resumida participan varios trasportadores energéticos, los electrones gracias a esto se “mueven” en trasportadores de electrones, en las cuales participan las enzimas. Se libera energía como el caso del ATP, durante estas reacciones. De igual manera, podemos apreciar estas reacciones redox en la fermentación, ciclo de kbres, cadena respiratoria, en la fotosíntesis, entre otras.
Materiales
- Cilindro graduado
- Goteros Embudos
- Tubo de ensayo
- Cuaderno de anotaciones
- Soluciones: permanganato de potasio, dicromato de potasio, yoduro de potasio, etanol, ácido sulfúrico concentrado, amoniaco puro, peróxido de hidrogeno.
Procedimiento y discusión
1 En un tubo de ensayos vierte 5ml de peróxido de hidrogeno (H2O2) comercial y lentamente 10 gotas de ácido sulfúrico concentrado (H2SO4). Agita con cuidado y deja enfriar la mezcla. Añade, gota a gota, 1ml de solución de permanganato de potasio (KMn4).

Ecuación química balanceada:

Ecuación iónica balanceada:

- Agente oxidante: KMnO4.
- En la reacción el número de oxidación del Mn disminuye +7 a +2, ganando electrones y se reduce.
- Agente reductor: H2O2 En la reacción el número de oxidación del oxígeno aumenta de -1 a 0, pierde 2e- y se oxida.
- En la reacción se observa el cambio en la coloración de la solución de KMnO4, y desprendimiento de un gas (burbuja).
2 En un tubo de ensayo vierte 3ml de dicromato de potasio (K2CrO7) y 10 gotas de ácido sulfúrico concentrado (H2SO4). Agita con cuidado y espera a que la mezcla se enfríe. Añade 1ml de alcohol etílico o etanol (CH3CH2OH). Percibe el olor con precaución.

Ecuación química balanceada:

Ecuación iónica balanceada:

- Agente oxidante: K2Cr2O7.
- En la reacción el número de oxidación del Cr disminuye +6 a +3, cada átomo de Cr gana 3 electrones y se reduce.
- Agente reductor: CH3CH2OH En la reacción el número de oxidación del C aumenta de -1 a +3 pierde 4 electrones y se oxida.
- En la reacción se observa un cambio en la coloración de la solución de K2Cr2O7 y se percibe un cambio en el olor, en la cual pasa al característico ácido acético.
3 En un tubo de ensayo vierte 5ml de peróxido de hidrógeno comercial (H2O2) y 10 gotas de ácido sulfúrico concentrado (H2SO4). Agita con cuidado y espera que se enfríe la mezcla. Añade 1ml de yoduro de potasio.

Ecuación química balanceada:

Ecuación iónica balanceada:
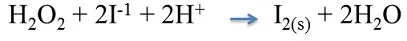
- Agente oxidante H2O2.
- En la reacción el número de oxidación de cada átomo de oxidación disminuye de -1 a -2, cada átomo gana 1 electrón y se reduce.
- Agente reductor KI En la reacción cada átomo de I al pasar su número de oxidación de -1 a 0, pierde 1 electrón y se oxida.
- En la reacción se observa la formación de un sólido insoluble o precipitado de color marrón rojizo correspondiente al I2(s).
4 Vierte 10ml de permanganato de potasio (KMnO4) y poco a poco vierte 20 gotas de ácido sulfúrico concentrado (H2SO4), agita con cuidado y ahora lo mezclas con cristales de sulfato ferroso (FeSO4).

Ecuación química balanceada:
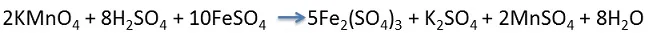
Ecuación iónica balanceada:

- Agente oxidante KMnO4.
- El átomo de Mn cambia su número de oxidación de +7 a +2, ganando 5 electrones y se reduce.
- Agente reductor FeSO4.
- Cada átomo de Fe pierde 1 electrón y se oxida.
5 En un tubo de ensayo vierte 5ml de permanganato de potasio (KMnO4) y 3 gotas de amoníaco (NH3).

Ecuación iónica balanceada:

- El agente oxidante KMnO4.
- El átomo de Mn disminuye su número de oxidación de +7 a +4 ganando 3 electrones y se reduce.
- Agente reductor NH3 El átomo de N aumente su número de oxidación de -3 a +5, pierde 8 e- y se oxida.
- En la reacción se observa un cambio en la coloración de la solución de permanganato de potasio y el tubo de ensayo se enfría.
Nota final
Cada una de las reacciones que mostré tiene sus evidencias, como lo es el caso de la imagen que aparece con el sulfato de cobre y hierro. Espero el próximo post, anexar esas experiencias que son muy conocidas pero que siempre son gratas compartir. Las actividades aprendiendo haciendo, tienen un plus didáctico con este tipo de estrategias es decir obtienen más valor y desarrollado correctamente es probable un aprendizaje eficaz durante la clase.
Referencia bibliográfica y fuente de las imágenes
- Cada una de las imágenes son propias, editadas en power point y paint.
- Reacciones puraquimica WEB. Consultado: 2018
- Experimentos de ciencia online. Consultado: 2018
- Aportes para la enseñanza para el nivel medio. Consultado 2018
- Portal educativo. Unidad de Reacciones Quimicas. UNAM. Mexico. Consultado: 2018