Fuente de imagen de pixabay
Saludos para toda la gente de exitosa de Steemit, también un gran saludo a grandes comunidades tales como: #cervantes, #proconocimiento, #entropia
según el concepto clásico de oxidación, cuando el hierro entra en contacto con el oxígeno se oxida, formando un óxido de hierro como el Fe2O3 , si en vez de oxigeno el gas que se envuelve al hierro es el cloro. Este también reacciona con él, formando FeCL3; podemos analizar lo siguiente que ambos casos el hierro ha pasado del estado elemental al iónico, si en el primer caso se ha dicho que el hierro se ha oxidado, en el segundo se tendrá que decir lo mismo.
Se denomina oxidación al fenómeno por el cual una especie química pierde electrones y se denomina reducción al fenómeno contrario a la oxidación, es decir el que proporciona ganancia de electrones, una oxidación va acompañada siempre de una reducción, ya que si una sustancia pierde electrones, otra ha de ganarlo. La sustancia que se oxida recibe el nombre de reductor y la que se reduce es el oxidante.
A continuación tenemos el siguiente aporte, de varias características que definen a las reacciones de oxidación-reducción.
1.- Los procesos que tienen lugar en una pila electroquímica pueden analizarse en función de dos semipilas.
2.- Las reacciones de oxidación-reducción pueden interpretarse como proceso de trasferencia electrónica.
3.- Átomos e iones compiten por los electrones.
4.- Los potenciales tipo de reducción de las semipilas son útiles para la predicción de las reacciones químicas.
5.- Las ecuaciones de oxidación-reducción pueden equilibrarse por el método de las semirreaciones o mediante el empleo de números de oxidación.
6.- La electrólisis representa un tipo de reacción útil. En ella, se obliga una pila química a funcionar en dirección opuesta a la de la reacción espontánea, al aplicar una tensión mayor que la producida por la misma pila.
Cita textual del libro Química: fundamentos experimentales. Guía del profesor por Robert W. Parry; pagina 188.
El concepto electrónico de oxidación-reducción no niega los conceptos clásicos, sino que los amplían a otras sustancias que esta viejas teorías no eran oxidantes ni reductores. Otras sustancias poseen un doble carácter, ya que según la sustancias que tengan enfrente pueden oxidarse o reducirse, como el siguiente caso en donde el azufre frente a un reductor fuerte puede reducirse a ion sulfuro: S+2e- = S²-, mientras que frente a un oxidante puede transformarse en un ión sulfito SO3²-, de tal forma lo que se quiere es documentar de forma educativa, de tal motivo en la moderna teorías pierden valor palabras como oxidante o reductor, ya que estos conceptos pasan a ser relativos y dependientes de más de una sustancia. Así el mismo oxígeno, entro tiempo oxidante por excelencia, pueden ser un reductor frente al flúor.
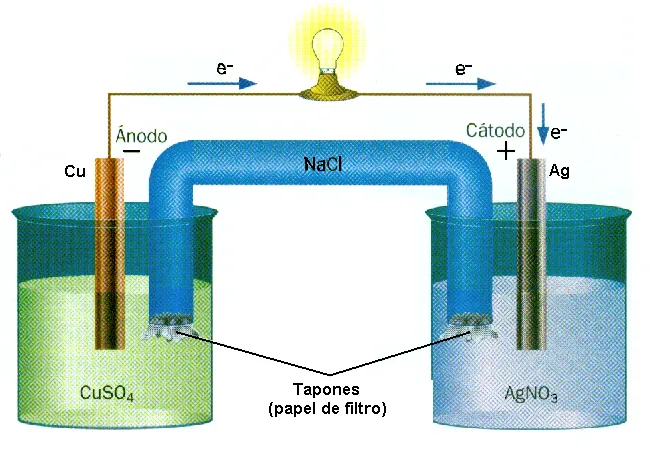
Conducción electrolíticas.
Las investigaciones efectuadas a principios del siglo XIX mostraron que las disoluciones acuosas de diversas sustancias químicas conducían la corriente eléctrica en distintas medidas, para poner más claro estos aporte al este contenido de conocimiento, en referencia a carácter conductor de las sustancias disueltas, basta con intercalar una lámpara en un circuito de manera sencilla, de tal manera lo que se trata de observar su brillo, que será el indicador de tal manera de saber, qué tanto es el conductor en la solución contenido en ella.
El físico y químico inglés Michael Faraday, denomino electrolitos a las sustancias disueltas conductoras de la corriente eléctrica; electrodos a los conductores metálicos en contactos con la disolución en donde siendo el ánodo el electrodo conectado al polo positivo y el cátodo el conectado al polo negativo; los iones a las partículas que conducen la corriente eléctrica en disolución, siendo los aniones los que se dirigen al ánodo y los aniones los que se dirigen al cátodos, en referencia al recipiente que contiene la disolución y los electrodos los llamo célula electrónica y al proceso químico producido por la corriente eléctrica es la electrólisis.
Electrólisis.
Es el conjunto de reacciones químicas que tiene lugar en los electrodos durante la conducción electrolítica, constituye la electrólisis, tomando como ejemplo apara mejor entendimiento, tenemos cuando se efectúa la electrolisis del H2O, los cationes H+ se trasladan hacia el electrodo negativo(cátodo) y los aniones OH- hacia el electrodos positivo (ánodo).
Las reacciones que tienen lugar en los electrodos son:
ÁNODO.
4OH-(aq)+2e- = O2(g)+h2O(1) Oxidación.
CÁTODO.
2H(aq)+2e- = H2(g) Reducción.
La reacción química global, que se produce en la célula electrónica se obtiene sumando las reacciones del ánodo y del cátodo, de modo que se pierda y se gane el mismo número de electrones.
2H2O(1)= O2(g)+2H2(g) La reacción química global.
Aporte de Michael Faraday.
Como resultado de sus investigaciones, Faraday enuncio las dos leyes siguientes, que rigen la electrolisis:
1.- La cantidad de un elemento que se deposita o libera en un electrodo es proporcional a la cantidad de electricidad que circula por la disolución.
2.- Las masa de distintos elementos depositados o liberados por la misma cantidad de electricidad son proporcionales a sus equivalentes químicos. La cantidad de electricidad que libera 1 equivalente gramo de cualquier elemento es de 96.496 culombios y recibe el nombre de 1 faraday.
Fuerza de los oxidantes y de los reductores.
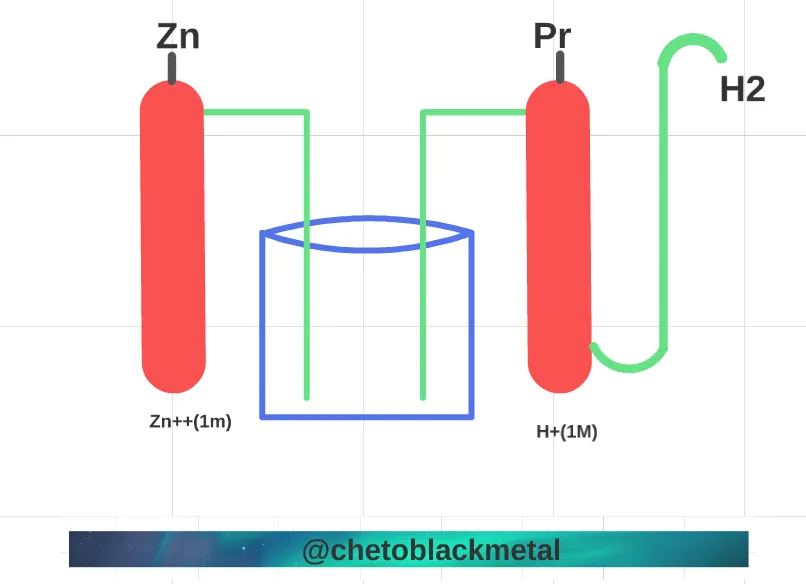
Fuerza de los oxidantes y de los reductores.(Imagen elaborada por @chetoblackmetal)
Por eso se denomina reacciones de precipitación a aquellas que tiene lugar entre especies iónicas en disolución para dar un compuesto sólido poco salubre y de mayor densidad que la disolución.
La Tecnología y Reacciones de oxidación-reducción.
Este un punto muy crucial de ciencia, gracias a su aporte y estudios, como el caso de las reacciones de oxidación-reducción, tiene mucha aplicación a nivel tecnológico, que ayudaron a la elaboración de muchas herramientas, materiales, equipos que usamos en nuestra vida cotidiana como son los siguientes:

Fuente de imagen de pixabay
También tenemos aplicando la electrólisis se fabricaron horno eléctrico, que se utiliza para fabricar aluminio, magnesio y sodio. El cual funciona de la siguiente manera, se calienta una carga de sales metálicas hasta que se funde y se ioniza; de tal forma que se deposita el metal electrolíticamente, este método se aplica con el sentido para refinar y tener lo más óptimo de pureza de los metales como: el plomo, el estaño, el cobre, el oro y la plata.

iss estación espacial, fuente de imagen de pixabay
En la actualidad se está trabajando en baterías de iones de litio, que soporten la altas temperatura en el espacio, también diría que soportar mucha radiación proveniente del Sol, de tal forma que sean recargable con el uso de células solares. Lo que se quiere es desarrollar fuente energía sanas libre de contaminante y aprovechar las fuente naturales, ya esta consideración esta siento tomada, porque se está trabajando e investigando sobre la aplicación de reacciones electroquímicas ecológicas, con el uso célula solar, tratando de no dañar el medio ambiente.

Fuente Bibliográfica consultada.
Apilados.com
Tú y la química - Página 705 por Andoni Garritz Ruiz - 2001.
Química: fundamentos experimentales. Guía del profesor - Página 188 por Robert W. Parry - 1974.
Física y Química 4 ESO - Página 224 por Dulce María Andrés Cabrerizo, Juan Luis Antón Bozal, Javier Barrio Pérez - 2008.
Química general. Introducción a la Química Teórica - Página 535 por Cristóbal Valenzuela Calahorro - 1995.