
Fig1.
Cet article s'inscrit dans une série de vulgarisation, une ode à la vie permettant d'entrevoir la place de l'Homme dans l'Univers, de la création de ce dernier à l'évolution des espèces animales.
Parties précédentes :
- INTRODUCTION : De l’Origine à la Raison, théorie du Chaos et Luca, Big Bang et nucléosynthèse,
- PARTIE 1 : Monde prébiotique et synthèse de la première cellule vivante :
Maintenant que vous avez lu mon article de la semaine dernière (n'est-ce pas ;) ), vous comprenez les bases du monde prébiotique, de sa chimie et de l'apparition de l'ARN.
Pour rappel, l'ARN est une chaîne de nucléotides complémentaires A (Adénine) U (Uracile) G (Guanine) C (Cytosine).
Les assemblages de séries successives des nucléotides codent l'information nécessaire à la catalyse de réactions chimiques que ce soit la synthèse de protéines ou sa propre réplication.
Je terminais le dernier post sur la réplication de l'ARN sans rentrer dans les détails.
La réplication étant une étape fondamentale permettant les caractères d'hérédité et d'évolution intrinsèques à la vie, plusieurs théories se succèdent pour expliquer comment les premiers ARNs ont pu atteindre ce stade.
Réplication de l'Acide Ribonucléique
Il existe globalement trois théories quant à la réplication de l'ARN1 :
- La polymérisation non-enzymatique dirigée à l'aide de modèles,
- La polymérisation par ribozymes ARN polymérases,
- Polymérisation mutuelle par réseau d'ARN autocatalytiques.
Polymérisation non-enzymatique dirigée
Dans les années 80, les laboratoires de Sid Altman et Tom Cech ont montré que l'ARN était capable de catalyser de nombreuses réactions chimiques dont la synthèse de nucléotides3. Ce n'est qu'en 2011 que Deck et al., montrèrent qu'un simple brin d'ARN pouvait provoquer la synthèse d'un brin complémentaire2.
Cette approche aborde la polymérisation via de faibles températures, des scénarios froids de l'ordre de 0 °C. Une telle température permet de stabiliser les liaisons succéssives des nucléotides en limitant les dégats engendrés par l'immersion : l'hydrolyse.
Bien que la terre à l'Hadéen fût beaucoup plus chaude que la terre que nous connaissons aujourd'hui, il est probable que des microclimats potentiellement sous les 0 °C aient existé, par exemple aux pôles1.
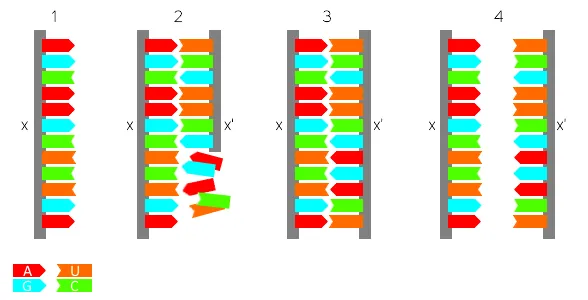
Fig2. Synthèse de l'ARN complémentaire x' à partir d'un brin x (1) et de précurseurs nucléotidiques (2).
Une fois synthétisé (3), le nouveau brin x' pourra servir à son tour de modèle pour synthétiser un nouveau x (4). On remarquera l'apparence cyclique des synthèses.
Polymérisation par ribozymes polymérases
Tout d'abord, il convient de revenir sur ce qu'est un ribozyme.
Un ribozyme - contraction de ribo (pour acide RIBOnucléique) et de zyme (enZYME) - est en réalité un ARN replié sur lui-même formant des zones d'accueils de Ligands4, permettant la fixation réversible de molécules définies pour permettre :
- Une stabilisation structurale,
- Une catalyse,
- Une modulation d'une activité enzymatique,
- Une transmission d'un signal.
Scénario par le froid, la polymérisation par ribozymes polymérases est une hypothèse pour le moins intéressante.
Ici, la réplication du brin d'ARN modèle ne se fait plus uniquement via complémentarité des bases, mais par l'action d'un ribozyme, ribozyme qui peut alors soit se répliquer lui-même soit répliquer un ARN de même longueur.
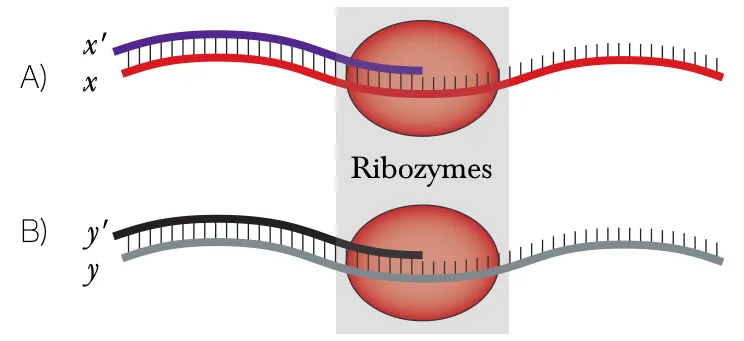
Fig3. Adaptation de Higgs et Lehman (2015). Schématisation d'une réplication via ribozyme. A étant une réplique x' d'une copie x' d'un ribozyme, B étant une réplique y' d'un ARN y de même longueur que le réplicateur.
Là où un ribozyme ne réplique en situation normale qu'environ la moitié de la chaîne totale5, Attwater et al.6 ont montré en 2013 qu'abaisser la température jusqu'à -7 °C dans une phase eutectique (i.e. une substance dont la température de solidification est plus basse que pour les composés purs) améliorait l'efficacité de l'ARN.
Pour la première fois, il était montré dans cette preuve de concept qu'un ARN sous la forme d'un ribozyme pouvait répliquer un ARN de même longueur (ici 206 nucléotides). Cette polymérisation est plus efficace que la polymérisation non-enzymatique se limitant à des chaînes de 30-50 nucléotides1.
Polymérisation mutuelle par réseau d'ARN autocatalytiques
La polymérisation par ribozymes pose un problème sérieux. Nécessitant un ARN de base d'environ 200 nucléotides pour former un ribozyme réplicateur, il est fort peu probable qu'une telle machine complexe se soit formée spontanément par chimie prébiotique.
L'idée derrière la polymérisation mutuelle par réseau d'ARN autocatalytiques est simple : diviser l'action du ribozyme en plusieurs autres morceaux d'ARN, plus petits et dont la formation spontanée est donc beaucoup plus probable en tenant compte du fait que de l'ARN d'environ 20-50 nucléotides peut être polymérisé grâce à des réplicateurs naturels comme l'argile1,7,8.
Le concept de groupement autocatalytique a été introduit par Kauffman en 1993 :
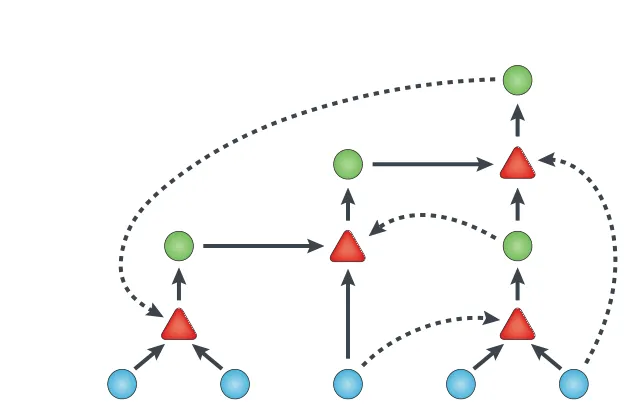
Fig4. Chaque composant du groupement (rond vert) peut être synthétisé (triangles rouges) par des précurseurs (ronds bleus) présents dans le milieu via des agents effecteurs du même groupe (du coup, les ronds verts dont l'action est matérialisée par les flèches en pointillés).
ARN répliqué, place à l'encapsulation
Ainsi, plusieurs théories solides servant de preuve de concept permettent d'appuyer le fait que l'ARN a pu se répliquer. Pour faire simple, résumons :
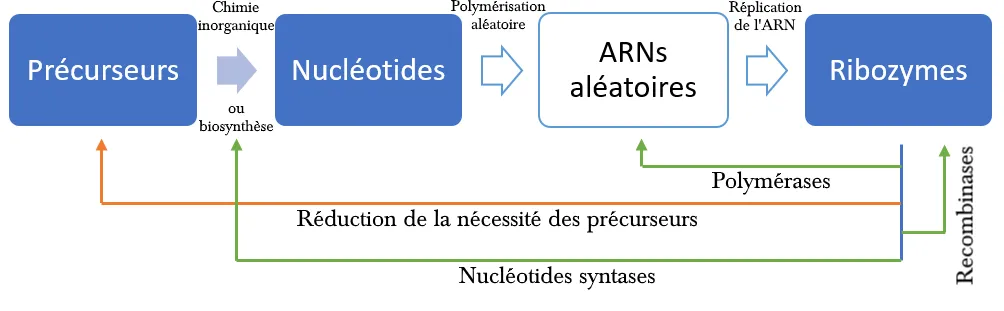
Fig5. Via des précurseurs, la chimie prébiotique produit des nucléotides. Via de l'argile ou d'autres composés inorganiques ou organiques, les nucléotides forment des fragments d'ARN aléatoires qui vont, les uns à l'aide des autres se répliquer en formant très rarement, des ribozymes.
Le premier ribozyme étant né, celui-ci pourra a l'aide des mêmes précurseurs se reproduire lui-même (recombinases), provoquer la biosynthèse des nucléotides, qu'il pourra alors polymériser en ARN non-aléatoire.
Maintenant que l'ARN est capable de se répliquer, une phase essentielle reste la formation d'une membrane pouvant protéger l'information et assurer le bon déroulement de la réplication, et pourquoi pas former les premières cellules procaryotes ! Mais ça, c'est pour la semaine prochaine ;) !
Références
- Higgs et Lehman, The RNA World: molecular cooperation at the origins of life. 2015.
- Deck, et al. Efficient enzyme-free copying of all four nucleobases templated by immobilized RNA. 2011. DOI : 10.1038/nchem.1086.
- Cell, A Molecular Approach, 4e Edition.
- Ligand (biologie)
- Wochner, et al. Ribozyme-catalyzed transcription of an active ribozyme. 2011.
- Attwater, et al. In-ice evolution of RNA polymerase ribozyme activity. 2013. DOI : 10.1038/NCHEM.1781.
- Huang et al. One-step, regioselective synthesis of up to 50-mers of RNA oligomers by montmorillonite catalysis. 2006.
- Hill et al. The limits of template-directed synthesis with nucleoside-5ʹ-phosphoro(2-methyl)imidazolides. 1993.
Pour aller plus loin
Attwater, et al. In-ice evolution of RNA polymerase ribozyme activity. 2013. DOI : 10.1038/NCHEM.1781.
Table des illustrations
- Fig1. Illustration personnelle, CC BY-SA-ND Clément POIRET,
- Fig2. Illustration personnelle, CC BY-SA Clément POIRET,
- Fig3. Illustration personnelle adaptée de Higgs et Lehman (2015 source1), CC0.
- Fig4. CC BY Higgs et Lehman, 2015.
- Fig5. Illustration personnelle, CC BY-SA Clément POIRET.

Bannière par @nitesh9 et @rocking-dave
Merci aux communautés SteemSTEM et FrancoSTEM pour leur aide et leur soutient ! <3